
用NA表示阿伏德罗常数,下列叙述正确的是()
A. 标准状况下,22.4LH2O含有的分子数为 NA
B. 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA
C. 通常状况下,NA 个CO2分子占有的体积为22.4L
D. 物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl﹣ 个数为 NA
考点: 阿伏加德罗常数.
分析: A.标准状况下,水的状态不是气体,不能使用标况下的气体摩尔体积计算水的物质的量;
B.1.06g碳酸钠的物质的量为0.01mol,0.01mol碳酸钠中含有0.02mol钠离子;
C.通常状况下,NA个CO2分子的物质的量为1mol,不是标况下,不能使用标况下气体摩尔体积计算二氧化碳的体积;
D.缺少氯化镁溶液的体积,无法计算溶液中氯离子的数目.
解答: 解:A.标况下水不是气体,不能使用标况下的气体摩尔体积计算22.4L水的物质的量,故A错误;
B.1.06g碳酸钠的物质的量为: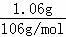 =0.01mol,0.01mol碳酸钠中含有0.02mol钠离子,含有的Na+离子数为0.02 NA,故B正确;
=0.01mol,0.01mol碳酸钠中含有0.02mol钠离子,含有的Na+离子数为0.02 NA,故B正确;
C.NA个CO2分子的物质的量为1mol,不是标准状况下,不能使用标况下的气体摩尔体积计算1mol二氧化碳的体积,故C错误;
D.没有告诉氯化镁溶液的体积,无法计算溶液中含有氯离子的数目,故D错误;
故选B.
点评: 本题考查阿伏加德罗常数的应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确标况下气体摩尔体积的使用条件:是否在标准状况下、标况下物质的状态是否为气体.


科目:高中化学 来源: 题型:
下列物质的沸点按由高到低的顺序排列正确的是()
①CH3(CH2)2CH3②CH3(CH2)3CH3③(CH3)3CH ④(CH3)2CHCH2CH3.
A. ②④①③ B. ④②①③ C. ④③②① D. ②④③①
查看答案和解析>>
科目:高中化学 来源: 题型:
在C(固)+CO2(气)=2CO(气)的反应中.现采取下列措施:
(1)增大压强;(2)增加碳的量;(3)通入CO2;(4)恒容下充入N2;(5)恒压下充入N2,哪些措施能够使反应速率增大?()
A. (1)(3) B. (3)(5) C. (1)(2)(3) D. 全部正确
查看答案和解析>>
科目:高中化学 来源: 题型:
在盛有碘水的试管中,加入少量CCl4后振荡,静置片刻后()
A. 整个溶液变紫色 B. 整溶液变为棕黄色
C. 上层为无色下层为紫红色 D. 下层无色上层紫红色
查看答案和解析>>
科目:高中化学 来源: 题型:
将标准状况下的a L HCl(g)溶于1000g水中,得到的盐酸密度为b g•cm﹣3,则盐酸的物质的量浓度是()
A. 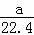 mol•L﹣1 B.
mol•L﹣1 B. 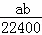 mol•L﹣1
mol•L﹣1
C. 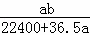 mol•L﹣1 D.
mol•L﹣1 D. 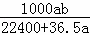 mol•L﹣1
mol•L﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
50mL质量分数为35%、密度为1.24g/mL的硫酸中,硫酸的物质的量浓度为()
A. 0.044mol/L B. 0.44mol/L C. 4.4mol/L D. 44mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
用18mol•L﹣1 浓硫酸配制100mL 3.0mol•L﹣1 稀硫酸的实验步骤如下:
①计算所用浓硫酸的体积②量取一定体积的浓硫酸 ③溶解④转移、洗涤⑤定容、摇匀
完成下列问题:
(1)所需浓硫酸的体积是 ,量取浓硫酸所用的量筒的规格是 (从下列中选用A.10mLB.25mLC.50mLD.100mL).
(2)下列情况对所配制的稀硫酸浓度有何影响?(用“偏大”“偏小”“无影响”填写)
A.所用的浓硫酸长时间放置在密封不好的容器中
B.容量瓶用蒸馏洗涤后残留有少量的水
C.所用过的烧杯、玻璃棒未洗涤
D.定容时俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
根据表中信息判断,下列选项不正确的是()
序号 反应物 产物
① KMnO4、H2O2、H2SO4 K2SO4、MnSO4
② Cl2、FeBr2 FeCl3、FeBr3
③ MnO4﹣ Cl2、Mn2+
A. 第①组反应的 其余产物为H2O和O2
其余产物为H2O和O2
B. 第②组反应中参加反应的Cl2与 FeBr2的物质的量之比为1:2
C. 第③组反应中生成1mol Cl2,转移电子2mol
D. 氧化性由强到弱顺序为MnO4﹣>Cl2>Fe3+>Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,甲池的总反应式为N2H4+O2=N2+2H2O,.下列说法正确的是()
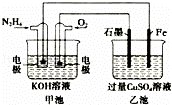
A. 甲池中负极上的电极反应式为N2H4﹣4e﹣=N2+4H+
B. 乙池中石墨电极上发生的反应为4OH﹣﹣4e﹣=2H2O+O2↑
C. 甲池溶液pH增大,乙池溶液pH减小
D. 甲池中每消耗0.1mol N2H4乙池电极上则会析出6.4g固体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com