
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源:2015-2016学年山西省高二上学期第一次月考化学试卷(解析版) 题型:选择题
对于可逆反应:2A(g)+B(g)?2C(g)△H<0,下列各图中正确的是
A.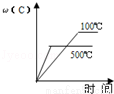 B.
B.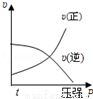
C.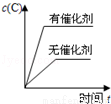 D.
D.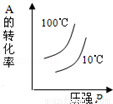
查看答案和解析>>
科目:高中化学 来源:2016届贵州省兴义市高三上学期期中测试理综化学试卷(解析版) 题型:实验题
(15分)Ⅰ.乙组同学用下列装置来证明铜与稀硝酸反应产生一氧化氮,
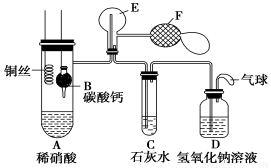
B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的双连打气球。
(1)实验时,先将B装置下移,使碳酸钙与稀硝酸接触产生气体,当C处产生白色沉淀时,立刻将B装置上提,使之与稀硝酸分离。该组学生设计此步操作的目的 。
(2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的离子方程式为________________________。
(3)装置E中开始时出现浅红棕色气体,用F向E中鼓入空气后,可观察到烧瓶E内气体颜色加深,产生上述现象的原因是 。
(4)一段时间后,C中白色沉淀溶解,其原因是____________________。
(5)装置D的作用是________________________。
Ⅱ.已知向含有淀粉的10mL0.2mol/LKIO3酸性溶液滴滴加0.3mol•L-1NaHSO3溶液的过程中,溶液的颜色先变蓝然后褪色,发生的离子反应如下:
①______IO3-+______HSO3-=_______I2+_______SO42-+_______H2O+ ________
②I2+HSO3-+H2O═2I-+SO42-+3H+
回答下列问题
(1)配平离子反应方程式①
______IO3-+______HSO3-=_______I2+_______SO42-+_______H2O+ ________
(2)根据①②反应写出还原性粒子HSO3-、I2、I-由强到弱的顺序_________________;
(3)当溶液刚好褪色时,则消耗的NaHSO3溶液的体积为___________________;
(4)预测已知向含有淀粉的NaHSO3溶液滴加KIO3溶液的现象____________________
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高二上学期第一次月考化学试卷(解析版) 题型:选择题
对可逆反应2A(s)+3B(g)  C(g)+2D(g)ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
C(g)+2D(g)ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是
①增加A的量,平衡向正反应方向移动
②升高温度,平衡向逆反应方向移动,v(正)减小
③压强增大一倍,平衡不移动,v (正)、v(逆)不变
④增大B的浓度,v(正)>v(逆)
⑤加入催化剂,B的转化率提高
A.①② B.④ C.③ D.④⑤
查看答案和解析>>
科目:高中化学 来源:2016届安徽省安庆市高三上学期第一次质检化学试卷(解析版) 题型:选择题
下列过程或现象与水解无关的是
A.纯碱溶液去油污
B.配制氯化铁溶液时加入少量的盐酸
C.NaHCO3与Al2(SO4)3混合作泡沫灭火剂
D.铁在潮湿的环境下生锈
查看答案和解析>>
科目:高中化学 来源:2016届吉林省扶余市高三上学期第一次月考化学试卷(解析版) 题型:选择题
氯仿(CHCl3)常因保存不慎而被氧化,产生剧毒物光气(COCl2):
2CHCl3+O2―→2HCl+2COCl2。下列说法不正确的有
A.CHCl3分子的空间构型为正四面体
B.COCl2分子中,中心C原子采用sp2杂化
C.COCl2中原子最外层都满足8电子结构
D.可用硝酸银溶液检验氯仿是否变质
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高二上学期第一次月考化学试卷(解析版) 题型:选择题

 已知:Ksp(AgCl)=1.8×10—10,Ksp(AgI)=1.5×10—16 ,Ksp(AgBr)=7.7×10—13,则下列难溶盐的饱和溶液中, Ag+浓度大小顺序正确的是
已知:Ksp(AgCl)=1.8×10—10,Ksp(AgI)=1.5×10—16 ,Ksp(AgBr)=7.7×10—13,则下列难溶盐的饱和溶液中, Ag+浓度大小顺序正确的是
A.AgCl>AgI> AgBr B.AgCl> AgBr>AgI
C.AgBr >AgCl>AgI D.AgBr >AgI>AgCl
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省高二上学期10月月考化学试卷(解析版) 题型:填空题
(10分)工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
CO(g)+H2O(g)  CO2(g)+H2(g) △H=-41 kJ/mol
CO2(g)+H2(g) △H=-41 kJ/mol
某小组研究在同温度下反应过程中的能量变化。他们分别在体积均为V L的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应。数据如下:
容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | ||||
CO | H2O | CO2 | H2 | ||||
① | 1 | 4 | 0 | 0 | t1 | 放出热量:32.8 kJ | |
② | 2 | 8 | 0 | 0 | t2 | 放出热量:Q | |
(1)该反应过程中,反应物分子化学键断裂时所吸收的总能量 (填“大于”、“小于”或“等于”)生成物分子化学键形成时所释放的总能量。
(2)容器①中反应达平衡时,CO的转化率为 %。
(3)计算容器②中反应的平衡常数K= 。
(4)下列叙述正确的是 (填字母序号)。
a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q > 65.6 kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.容器①中,反应的化学反应速率为:v(H2O)=4/Vt1mol/(L·min)
(5)已知:2H2(g)+O2(g)==2H2O(g)ΔH=-484kJ/mol,
写出CO完全燃烧生成CO2的热化学方程式: 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高二上期中考试化学试卷(解析版) 题型:选择题
下列运用与碳酸钠或碳酸氢钠能发生水解的事实无关的是
A.实验室盛放碳酸钠溶液的试剂瓶必须用橡胶塞而不能用玻璃塞
B.泡沫灭火器用碳酸氢钠溶液和硫酸铝溶液,使用时只需将其混合就可产生大量二氧化碳的泡沫
C.厨房中常用碳酸钠溶液洗涤餐具上的油污
D.可用碳酸钠与醋酸制取少量二氧化碳
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com