
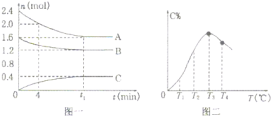
【题目】在10L密闭容器中,A、B、C三种气态物质构成了可逆反应的体系。一定条件下,A、B、C三种物质物质的量![]() 与时间
与时间![]() 的关系如图一所示,C的百分含量
的关系如图一所示,C的百分含量![]() 与温度
与温度![]() 的关系如图二所示。下列分析错误的是
的关系如图二所示。下列分析错误的是
A.![]() 时,A的平均反应速率为
时,A的平均反应速率为![]()
B.图二中![]() 、
、![]() 对应曲线上的点都处于化学平衡状态
对应曲线上的点都处于化学平衡状态
C.由![]() 向
向![]() 变化时,
变化时,![]()
D.该反应的正反应为吸热反应
【答案】D
【解析】
根据图1知,随着反应的进行,A和B的物质的量减少,C的物质的量增大,则A和B是反应物,C是生成物,反应过程中,物质的量的变化量之比等于其计量数之比,所以A、B和C的计量数之比=(2.4-1.6)mol:(1.6-1.2)mol:(0.4-0)mol=0.8mol:0.4mol:0.4mol=2:1:1,当反应达到T3时,再升高温度C的含量降低,则正反应是放热反应,该反应的方程式为:2A(g)+B(g)![]() C(g)△H<0。
C(g)△H<0。
A.04分钟时,A的平均反应速率v=![]() =
=![]() =0.01mol/(Lmin),故A正确;
=0.01mol/(Lmin),故A正确;
B.0到T3是平衡的建立,T3后是平衡的移动,T3后的所有点都是对应温度下的平衡状态,所以图二中T3、T4对应曲线上的点都处于化学平衡状态,故B正确;
C.由T1向T2变化时,C的含量增大,平衡向正反应方向移动,则正反应速率大于逆反应速率,故C正确;
D.当反应达到T3时,再升高温度C的含量降低,该反应正反应是放热反应,故D错误;
答案选D。


 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】(1)氯化铁水溶液呈___性,原因是(用离子方程式表示):___;把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是___;热的纯碱溶液去油污能力强,纯碱水解的离子方程式为___(写第一步即可)。
(2)普通泡沫灭火器是利用NaHCO3溶液跟Al2(SO4)3溶液混合,产生大量的气体和沉淀,气体将混合物压出灭火器,相关反应的离子方程式是___。
(3)已知:在相同条件下醋酸与氨水电离程度相同,现有浓度均为0.1mol/L的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸铵、⑦硫酸氢铵、⑧氨水。
①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号)___;
④、⑤、⑥、⑦、⑧五种溶液中NH4+浓度由大到小的顺序是(填序号)___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知电导率越大导电能力越强。常温下用0.100 mol·L-1NaOH溶液分别滴定10.00mL浓度均为0.100 mol·L-1的盐酸和醋酸溶液,测得滴定过程中溶液的电导率如图所示。下列说法正确的是

A. 曲线①代表滴定盐酸的曲线
B. 滴定醋酸的过程应该选择甲基橙作为指示剂
C. a、b、c三点溶液中水的电离程度:c>a>b
D. b点溶液中:c(OH-)>c(H+)+c(CH3COO-)+c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaOH溶液可用于多种气体的处理.
(1)CO2是温室气体,可用NaOH溶液吸收得到Na2CO3或NaHCO3.
①Na2CO3俗称纯碱,因CO32﹣水解而使其水溶液呈碱性,写出CO32﹣第一步水解的离子方程式_________.已知25℃时,CO32﹣第一步水解的平衡常数Kh=2×10﹣4mol/L,当溶液中c(HCO3﹣):c(CO32﹣)=20:1 时,溶液的pH=_____.
②泡沫灭火器中通常装有NaHCO3 溶液和Al2(SO4)3溶液,请写出这两种溶液混合时的离子反应方程式__________.
(2)金属与浓硝酸反应产生的NO2可用NaOH溶液吸收,反应方程式为:2NO2+2NaOH=NaNO3+NaNO2+H2O.含0.2molNaOH的水溶液与0.2mol NO2恰好完全反应得1L溶液A,溶液B为0.lmolL﹣1CH3COONa溶液,则两份溶液中c(NO3﹣)、c(NO2﹣)和c(CH3COO﹣)由大到小的顺序为___________(已知HNO2的电离常数Ka=7.1×10﹣4molL﹣1,CH3COOH的电离常数Ka=1.7×10﹣5molL﹣1).可使溶液A和溶液B的 pH相等的方法是_____.
A.向溶液A中加适量NaOH B.向溶液A中加适量水
C.向溶液B中加适量NaOH D.向溶液B中加适量水
(3)烟气中的SO2会引起酸雨,可利用氢氧化钠溶液吸收。吸收SO2的过裎中,溶液中H2SO3、HSO3﹣、SO32﹣三者所占物质的量分数(a)随pH变化的关系如图所示:

①图中pH=7时,溶液中离子浓度关系正确的是___。
A.c(Na+)>2c(SO32﹣)>c(HSO3﹣)
B.c(Na+)=c(SO32﹣)+c(HSO3﹣)+c(H2SO3)
C.c(OH﹣)=c(H+)+c(H2SO3)+c(HSO3﹣)
D.c(Na+)>c(HSO3﹣)>c(SO32﹣)>c(H+)=c(OH﹣)
②利用上图中数据,求反应H2SO3![]() H++ HSO3﹣的平衡常数的数值____.
H++ HSO3﹣的平衡常数的数值____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绝热容器中发生反应:3Z(s)![]() X(g)+2Y(g)△H=a kJ·mol-1(a>0)。下列说法不正确的是
X(g)+2Y(g)△H=a kJ·mol-1(a>0)。下列说法不正确的是
A.将0.3 mol Z置于容器中充分反应生成气体的物质的量一定小于0.3 mol
B.达到化学平衡状态时,气体平均摩尔质量不变
C.容器中放入3mol Z,达到化学平衡状态时,反应吸收的总热量为a kJ
D.容器温度不变,反应已经达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示。
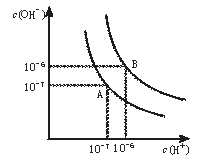
(1)若以A点表示25℃时水在电离平衡时的离子浓度,当温度升到100℃时,水的电离平衡状态到B点,则此时水的离子积从___增加到___。
(2)将100℃的pH=8的Ba(OH)2溶液与100℃的pH=5的稀盐酸混合,并保持100℃的恒温,欲使混合溶液pH=7,则Ba(OH)2与盐酸的体积比为___。
(3)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为(填序号)___。
A.9 B.13 C.11~13之间 D.9~11之间
(4)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号)___。
A.氨水与氯化铵发生化学反应
B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH-)减小
(5)室温下,如果将0.1molNH4Cl和0.05molNaOH全部溶于水,形成混合溶液(假设无损失),
①___和____两种粒子的物质的量之和等于0.1mol。
②___和___两种粒子的物质的量之和比OH-多0.05mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中![]() 假设容器体积不变,固体试样体积忽略不计
假设容器体积不变,固体试样体积忽略不计![]() ,使其达到分解平衡:
,使其达到分解平衡:![]() 。实验测得不同温度下的平衡数据列于下表:
。实验测得不同温度下的平衡数据列于下表:
温度 |
|
|
|
|
|
平衡气体总浓度 |
|
|
|
|
|
下列有关叙述正确的是
A.该可逆反应达到平衡的标志之一是混合气体平均相对分子质量不变
B.因该反应![]() 、
、![]() ,所以在低温下自发进行
,所以在低温下自发进行
C.达到平衡后,若在恒温下压缩容器体积,体系中气体的浓度增大
D.根据表中数据,计算![]() 时的分解平衡常数约为
时的分解平衡常数约为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答问题:
Ⅰ.常温下,CaS的Ksp=10-8,饱和溶液中存在平衡: CaS(s)![]() Ca2+(aq)+S2-(aq)
Ca2+(aq)+S2-(aq)
(1)①该温度下,将10-4mol/L氯化钙溶液与2×10-4mol/L硫化钠溶液等体积混合,能否产生沉淀?答___;温度升高时,Ksp__(填“增大”、“减小”或“不变”下同)。
②滴加少量浓盐酸,c(Ca2+)___,原因是___(用文字和离子方程式说明)。
(2)若向CaS悬浊液中加入CuSO4溶液,生成一种黑色固体物质,写出该过程中反应的离子方程式___。
Ⅱ.(已知Ksp[Fe(OH)3]=10-38)若0.01mol/L FeCl3溶液中,如果要生成Fe(OH)3沉淀,应调整溶液pH,使pH___,若要使其沉淀完全,pH应___。(提示:填数据时,要有>,<,=)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向下列溶液中通入相应的气体至溶液pH=7(通入气体对溶液体积的影响可忽略),溶液中部分微粒的物质的量浓度关系正确的是( )
A. 向0.10mol·L-1NH4HCO3溶液中通入CO2:c(NH4+)=c(HCO3-)+c(CO32-)
B. 向0.10mol·L-1NaHSO3溶液中通入NH3:c(Na+)>c(NH4+)>c(SO32-)
C. 0.10mol·L-1Na2SO3溶液通入SO2:c(Na+)=2[c(SO32-)+c(HSO3-)+c(H2SO3)]
D. 0.10mol·L-1CH3COONa溶液中通入HCl:c(Na+)>c(CH3COOH)=c(Cl-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com