Ⅰ.现有m g某气体X2,它的摩尔质量为M g?mol-1.若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为______mol.
(2)该气体所含原子总数为______个.
(3)该气体在标准状况下的体积为______L.
Ⅱ.20℃时,20mL NaCl饱和溶液质量为24g,将其蒸干后得食盐6.34g,则20℃时,食盐的溶解度为______,此时食盐饱和溶液的质量分数为______,物质的量浓度为______.
Ⅲ. 实验室常用的浓盐酸密度为1.17g?mL-1,质量分数为36.5%.
(1)此浓盐酸的物质的量浓度为______.
(2)取此浓盐酸50 mL,用蒸馏水稀释为200 mL,稀释后盐酸的物质的量浓度为______.
(3)将13 g 锌投入足量的上述实验所得的稀盐酸中,充分反应后,求:
①放出的H2在标准状况下的体积______.
②将生成的H2通过足量的灼热CuO,求生成铜的质量(假设氢气在反应中没有损失)______.
解:Ⅰ、(1)该气体的物质的量为:n=

=
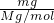
=

mol;
(2)该气体为双原子分子,则原子总个数为:N=2nN
A=

;
(3)该气体在标准状况下的体积为:V=nVm=

L,
故答案为:

;

;

;
Ⅱ、溶解度计算公式为:
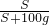
=
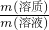
,代入数据得:

=
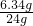
,解之得:S=35.9 g;
质量分数计算公式为:w=
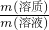
×100%,代入数值得w=26.4%;
物质的量浓度计算公式为:c=

,代入数值得:c(NaCl)=5.42 mol/L.
故答案为:35.9 g;26.4%;5.42 mol/L;
Ⅲ、(1)此浓盐酸的物质的量浓度为c=

=
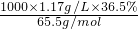
=11.7mol/L;
(2)取此浓盐酸50 mL,则溶质的物质的量为:0.05L×11.7mol/L=0.585mol,
用蒸馏水稀释为200 mL,稀释后盐酸的物质的量浓度为
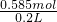
=2.925mol/L;
(3)①13 g 锌的物质的量为
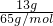
=0.2mol,
Zn+2HCl═ZnCl
2+H
2↑
1mol 22.4L
0.2mol V
V=
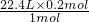
=4.48L,
所以放出的H
2在标准状况下的体积为4.48L;
②设生成铜的质量为m,
H
2+CuO

Cu+H
2O
22.4L 64g
4.48L m
m=
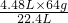
=12.8g,
所以生成铜的质量为12.8g.
故答案为:11.7 mol/L;2.925 mol/L;4.48 L;12.8 g.
分析:Ⅰ、根据n=

=
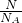
=

计算;
Ⅱ、根据溶解度计算公式
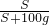
=
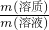
;质量分数计算公式w=
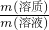
×100%;物质的量浓度计算公式c=

计算;
Ⅲ、根据c=

计算溶液的物质的量浓度,根据化学方程式计算生成的气体的体积和生成铜的质量.
点评:本题考查溶液浓度的计算,注意物质的量与质量、物质的量浓度以及溶解度的计算公式的运用,注意物质的量应用于化学方程式的计算.

 =
=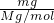 =
= mol;
mol; ;
; L,
L, ;
; ;
; ;
;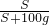 =
=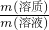 ,代入数据得:
,代入数据得: =
=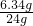 ,解之得:S=35.9 g;
,解之得:S=35.9 g;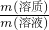 ×100%,代入数值得w=26.4%;
×100%,代入数值得w=26.4%; ,代入数值得:c(NaCl)=5.42 mol/L.
,代入数值得:c(NaCl)=5.42 mol/L. =
=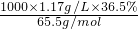 =11.7mol/L;
=11.7mol/L;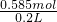 =2.925mol/L;
=2.925mol/L;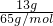 =0.2mol,
=0.2mol,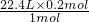 =4.48L,
=4.48L, Cu+H2O
Cu+H2O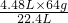 =12.8g,
=12.8g, =
=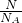 =
= 计算;
计算;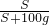 =
=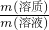 ;质量分数计算公式w=
;质量分数计算公式w=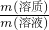 ×100%;物质的量浓度计算公式c=
×100%;物质的量浓度计算公式c= 计算;
计算; 计算溶液的物质的量浓度,根据化学方程式计算生成的气体的体积和生成铜的质量.
计算溶液的物质的量浓度,根据化学方程式计算生成的气体的体积和生成铜的质量.

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案