
| A. | 盐酸 | B. | 硫酸 | C. | 高氯酸 | D. | 醋酸 |
分析 pH=3的各酸溶液中c(H+)=0.001mol/L,反应反应的本质为H++OH-=H2O,盐酸、硫酸、高氯酸都是强酸,完全电离,醋酸为弱酸,溶液中只有部分发生电离,溶液中存在大量的醋酸分子,氢离子反应后会继续提供氢离子,据此判断.
解答 解:pH=3的各酸溶液中c(H+)=0.001mol/L,发生反应的本质为H++OH-=H2O,
盐酸、硫酸、高氯酸都是强酸,完全电离,三者消耗氢氧化钠的体积相等;
醋酸为弱酸,溶液中只有部分发生电离,溶液中存在大量的醋酸分子,氢离子反应后会继续提供氢离子,消耗氢氧化钠的体积最大,
故选D.
点评 本题考查酸碱中和反应本质、强弱电解质等,比较基础,注意基础知识的理解掌握,注意把握弱酸中氢离子浓度与酸的浓度的关系.


科目:高中化学 来源: 题型:选择题
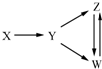 一定条件下,下列各组物质能一步实现图所示转化关系的是( )
一定条件下,下列各组物质能一步实现图所示转化关系的是( )| 选项 | X | Y | Z | W |
| A | Al | Al2O3 | NaAlO2 | Al(OH)3 |
| B | Fe3O4 | Fe | FeCl2 | FeCl3 |
| C | H2SO4 | SO2 | S | SO3 |
| D | CH3CH2Br | CH2═CH2 | C2H5OH | CH2BrCH2Br |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入少量0.1 mol/L HCl溶液,溶液中c(H+)不变 | |
| B. | 加入少量CH3COONa固体,平衡向正反应方向移动 | |
| C. | 加入水时,平衡向逆反应方向移动 | |
| D. | 加入少量NaOH固体,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若Vl=V2,且混合溶液pH<7,则必有c1<c2 | |
| B. | 若混合溶液的pH=7,则混合溶液中c(Na+)=c (CH3COO-)+c(CH3COOH ) | |
| C. | 若混合溶液的pH>7,则混合溶液中c(Na+)<c( CH3COO-) | |
| D. | 若Vl=V2,c1=c2,则混合溶液中c(OH-)=c(CH3COOH)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硝酸银溶液 | B. | 石蕊试液 | ||
| C. | 含酚酞的氢氧化钠溶液 | D. | 淀粉碘化钾试纸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a}{A}$(A-N)mol | B. | $\frac{a}{A+2m}$ (A-N+m)mol | C. | $\frac{a}{A+2m}$(A-N)mol | D. | $\frac{a}{A+m}$(A-N+m)mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com