
| A. | NaCl 溶液 | B. | NaBr 溶液 | C. | NaI 溶液 | D. | Na2S 溶液 |
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强电解质的导电能力可能弱于弱电解质 | |
| B. | 二氧化碳的水溶液能够导电,因此二氧化碳是电解质 | |
| C. | 金属氧化物都是碱性氧化物 | |
| D. | 胶体和溶液的本质区别是丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用可再生资源、用超临界二氧化碳替代有机溶剂、注重原子的经济性、采用低能耗生产工艺等都是绿色化学的内容 | |
| B. | 食盐、食醋、食用油均可用作食品添加剂,都属于有机物 | |
| C. | 碳酸钡、碳酸氢钠、氢氧化铝均可作为抗酸药物使用 | |
| D. | 石油分馏、煤的气化、海水晒盐、碱去油污、花生中提取花生油等过程都是物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子的最外层电子数等于族序数 | |
| B. | 主族元素X、Y能形成XY3型化合物,序数差可能为2、6或8 | |
| C. | 分子结构相似的分子相对分子质量越大熔沸点越高 | |
| D. | 元素的原子得电子越多非金属性越强,失电子越多,金属性越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
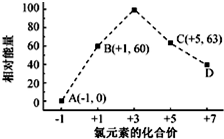 元素周期表中第 VIIA族元素的单质及其化合物的用途广泛.
元素周期表中第 VIIA族元素的单质及其化合物的用途广泛.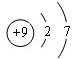 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com