
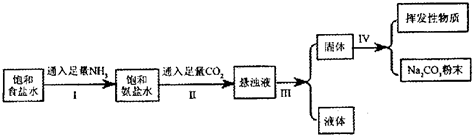
| 物质 | NH4Cl | NaHCO3 | Na2CO3 | NaCl |
| 溶解度/g | 37.2 | 9.6 | 21.5 | 36.0 |
| ||
| ||
|
| 44w-84w3+84w1 |
| 44×22 |
| 53(11W+21W1-21W3) |
| 121W |
| 106(11W+21W1-21W3) |
| 242W |
| 53(11W+21W1-21W3) |
| 121W |
| 106(11W+21W1-21W3) |
| 242W |


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案科目:高中化学 来源: 题型:
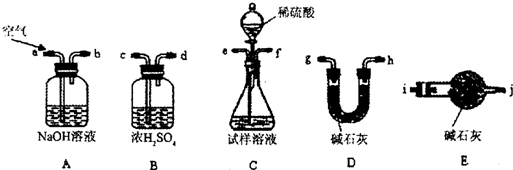
 某化学兴趣小组为了探究在常温下某非金属氧化物形成的未知气体的成分.该小组成员将气体通入澄清石灰水,发现变浑浊,持续通入发现浑浊又变澄清,由此该小组成员对气体的成分提出猜想.
某化学兴趣小组为了探究在常温下某非金属氧化物形成的未知气体的成分.该小组成员将气体通入澄清石灰水,发现变浑浊,持续通入发现浑浊又变澄清,由此该小组成员对气体的成分提出猜想.查看答案和解析>>
科目:高中化学 来源: 题型:
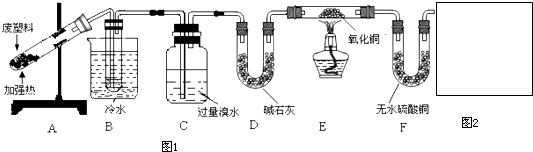
查看答案和解析>>
科目:高中化学 来源: 题型:
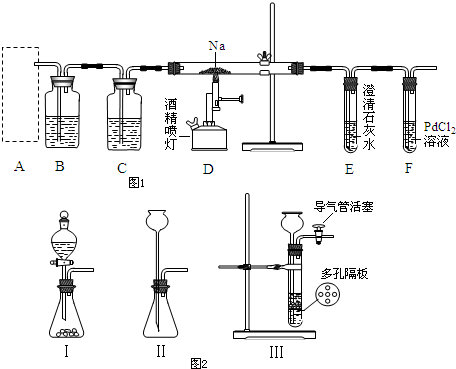
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com