
【题目】下列说法正确的是( )
A.亚甲基蓝和亚甲基白在碱性条件下都不能稳定存在
B.亚甲基蓝变为亚甲基白后,通常不能再复原为亚甲基蓝
C.亚甲基白变为亚甲基蓝后,通常不能再复原为亚甲基白
D.亚甲基白不稳定,能缓慢释放出氧气
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应:A(g)+3B(g)2C(g),有关下列图象说法的不正确的是( ) 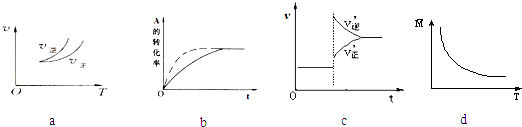
A.依据图a可判断正反应为放热反应
B.在图b中,虚线可表示使用了催化剂
C.若正反应的△H<0,图c可表示升高温度使平衡向逆反应方向移动
D.由图d中混合气体的平均相对分子质量随温度的变化情况,可推知正反应的△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫有多种含氧酸,亚硫酸(H2SO3)、硫酸(H2SO4)、焦硫酸(H2SO4SO3)、硫代硫酸(H2S2O3)等等,其中硫酸最为重要,在工业上有广泛的应用.在实验室,浓硫酸是常用的干燥剂.完成下列计算:
(1)焦硫酸(H2SO4 . SO3)溶于水,其中的SO3都转化为硫酸.若将445g焦硫酸溶于水配成4.00L硫酸,该硫酸的物质的量浓度为mol/L.
(2)若以浓硫酸吸水后生成H2SO4 . H2O计算,250g质量分数为98%的硫酸能吸收多少g水?
(3)硫铁矿是工业上制硫酸的主要原料.硫铁矿氧化焙烧的化学反应如下:3FeS2+8O2→Fe3O4+6SO2 4FeS2+11O2→2Fe2O3+8SO2
若48molFeS2完全反应耗用氧气2934.4L(标准状况),计算反应产物中Fe3O4与Fe2O3物质的量之比.
(4)用硫化氢制取硫酸,既能充分利用资源又能保护环境,是一种很有发展前途的制备硫酸的方法.硫化氢体积分数为0.84的混合气体(H2S、H2O、N2)在空气中完全燃烧,若空气过量77%,计算产物气体中SO2体积分数(水是气体).
已知空气组成:N2体积分数0.79、O2体积分数0.21.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列蓝瓶子实验,振荡周期最短的是( )
水 | 葡萄糖 | 0.1%亚甲基蓝 | NaOH溶液 | 温度 | |
A | 50 mL | 1.5 g | 8滴 | 2 mL | 40 ℃ |
B | 50 mL | 1.5 g | 10滴 | 2 mL | 40 ℃ |
C | 50 mL | 1.5 g | 8滴 | 2 mL | 25 ℃ |
D | 50 mL | 1.5 g | 10滴 | 2 mL | 25 ℃ |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四类反应:①置换反应 ②复分解反应 ③只有一种元素化合价发生变化的反应 ④离子反应,其中一定不是氧化还原反应的是( )
A. 只有② B. 只有③ C. 只有②④ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是摘取学生实验报告单中的语句,其中说法正确的是( )
A.日常生活中不能用粥汤检验碘盐中是否含有KIO3
B.将铁屑、浓溴水、苯混合可制得溴苯
C.用蒸馏方法除去乙醇中的水
D.洗涤沉淀时,应用玻璃棒轻轻搅拌,使得沉淀表面上的杂质溶于水中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有一瓶混有少量NaCl杂质的NaOH固体试剂,为准确测其纯度,采用盐酸滴定法进行测定.
①称取Wg NaOH固体试剂配制成100.00mL水溶液备用;
②将浓度为 c mol/L的标准盐酸装在用标准盐酸润洗过的25.00mL酸式滴定管中,调节液面位置在零刻度以下,并记下刻度;
③取V1mL NaOH待测溶液置于洁净的锥形瓶中,加入2~3滴甲基橙指示剂充分振荡,然后用浓度为c mol/L的标准盐酸滴定,重复测定3次,平均用去盐酸V2mL.
试回答:
(1)配制标准盐酸溶液时,必须使用的最主要玻璃仪器是 .
(2)滴定时,滴定过程中两眼应该注视 . 滴定终点时溶液颜色由色突变为色.在盛放待测溶液的锥形瓶下方放一张白纸的作用是 .
(3)下列操作会使实验测得结果偏大的是(填选项的序号);
A.用湿润的pH试纸测定某NaOH溶液的pH
B.中和滴定实验中用蒸馏水洗净的锥形瓶直接装待测液
C.若滴定前酸式滴定管尖嘴气泡未排出,滴定结束后气泡消失
D.装标准盐酸的酸式滴定管没有进行润洗
E.读数时,若滴定前仰视,滴定后俯视
(4)固体试剂NaOH的质量分数的表达式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A~G有如图所示的转化关系(部分生成物已略去),其中A、G为单质,D是能使湿润的红色石蕊试纸变蓝色的气体,E、F均能与NaOH溶液反应.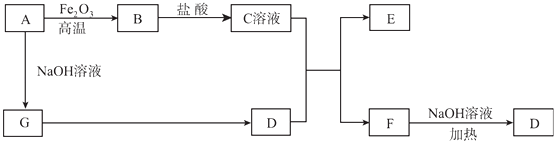
请回答下列问题:
(1)写出F的电子式:;
(2)①C溶液与D的水溶液反应的离子方程式为;②F溶液与NaOH溶液共热反应的化学方程式为;
(3)①请用离子方程式解释C溶液为何显酸性;②F溶液中离子浓度由大到小的顺序为;
(4)将5.4 g A投入到200 mL 2.0 mol/L某溶液中有G单质产生,且充分反应后有金属剩余,则该溶液可能是(填代号);
A.HNO3溶液
B.H2SO4溶液
C.NaOH溶液
D.HCl溶液
(5)将1mol N2和3mol G及催化剂充入容积为2 L的某密闭容器中进行反应,已知该反应为放热反应.平衡时,测得D的物质的量浓度为a mol/L.在其他条件不变的情况下,若起始时充入0.5 mol N2和1.5mol G达到平衡后,D的物质的量浓度(填“大于”“小于”或“等于”)a/2mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用20 mL 18.4 mol/L浓H2SO4和铜共热一段时间后,使反应混合物冷却,滤去多余的铜,将滤液加水定容到100 mL,测得SO42-离子物质的量浓度为3. 18 mol/L。试求溶液中CuSO4的物质的量浓度( )
A. 0.50 mol/L B. 0.75 mol/L C. 1.00 mol/L D. 3.18 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com