
 氮可以形成多种化合物,如NH3、N2H4、HCN、NH4NO3等.
氮可以形成多种化合物,如NH3、N2H4、HCN、NH4NO3等.分析 (1)①a、N2(g)+2H2(g)═N2H4(l);△H=+50.6kJ•mol-1
b、2H2(g)+O2(g)═2H2O(l);△H=-571.6kJ•mol-1
依据盖斯定律b-a得到N2H4(l)+O2(g)═N2(g)+2H2O(l);依据热化学方程式和盖斯定律来计算;
②依据△H-T△S<0判断反应自发进行;
③用次氯酸钠氧化氨,可以得到N2H4和氯化钠,据此书写方程式;
(2)电解池中阴离子在阳极失电子发生氧化反应;
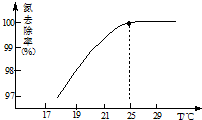
(3)①依据氨气溶解度随温度增大减小分析;
②氧化镁是难溶物质;
(4)依据滴定实验步骤和滴定用量结合化学方程式计算分析得到.
解答 解:(1)①a、N2(g)+2H2(g)═N2H4(l);△H=+50.6kJ•mol-1
b、2H2(g)+O2(g)═2H2O(l);△H=-571.6kJ•mol-1
依据盖斯定律b-a得到N2H4(l)+O2(g)═N2(g)+2H2O(l);△H=-622.2KJ/mol,
故答案为:-622.2;
②N2(g)+2H2(g)═N2H4(l)不能自发进行的原因是△H-T△S>0,则反应△S<0,△H>0,故答案为:△H>0,△S<0;
③用次氯酸钠氧化氨,可以得到N2H4和氯化钠,方程式为:NaClO+2NH3=N2H4+NaCl+H2O,故答案为:NaClO+2NH3=N2H4+NaCl+H2O;
(2)用铂电极电解硫酸氢钾溶液,在阳极上生成S2O82-,HSO4-离子在阳极失电子生成S2O82-,电极反应为:2HSO4--2e-═S2O82-+2H+,
故答案为:2HSO4--2e-═S2O82-+2H+;
(3)①在25℃前,升高温度氮去除率增大的原因是因为氨气溶解度随温度升高,溶解度减小,
故答案为:升高温度NH3的溶解度降低,有利于NH3的逸出;
②剩余的氧化镁,是难溶于水的物质沉淀出不形成污染,不会对废水形成二次污染,
故答案为:氧化镁难溶于水中,以沉淀的形式排出,因此不会形成二次污染;
(4)依据滴定实验和反应化学方程式可知:
2NH3~(NH4)2B4O7~H2SO4
2 1
2×cV×10-3mol cV×10-3mol
水样中氮的含量=$\frac{2cV×1{0}^{-3}mol×14g/mol}{0.01L}$=2.8cV(g/L)=2800cV(mg/L),
故答案为:2800cV.
点评 本题考查了热化学方程式和盖斯定律计算应用,电极原理的分析判断电极书写,实验过程分析理解,滴定实验的计算应用,题目难度中等.


科目:高中化学 来源: 题型:解答题

| 第一次 | 第二次 | 第三次 | |
| 体积(mL) | 16.10mL | 16.60mL | 15.90mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl- NO3- Ba2+ Fe3+ | B. | SO42- S2- Al3+ Mg2+ | ||
| C. | Na+ K+ SO42- Cl- | D. | NH4+ Ba2+ Cl- HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
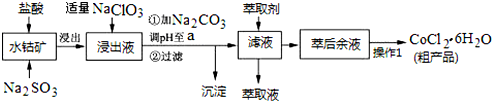
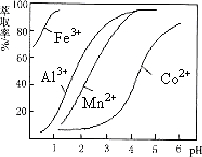
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质子数和中子数均为6的碳原子:${\;}_{6}^{6}C$ | |
| B. | 硫离子的结构示意图: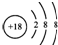 | |
| C. | 氢氧化钠的电子式: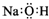 | |
| D. | 2-丙醇的结构简式: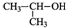 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
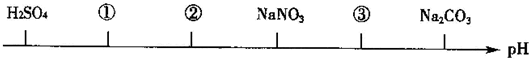
| A. | CuCl2 CH3COOH NaOH | B. | HCl H2SO3 NaHCO3 | ||
| C. | HF HCl CH3COONa | D. | NH4Cl HCl CH3COONa |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C10H8和C6H8O3 | B. | C2H2和C6H6 | C. | C2H4和C3H6 | D. | CH4和C2H4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com