
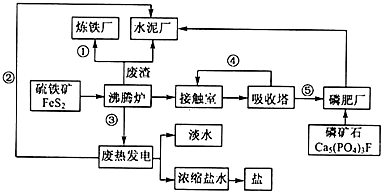
 生态工业园区的建设,不仅仅是体现环保理念,重要依据循环经济理论和充分考虑经济的可持续发展,如图是某企业设计的硫酸-磷铵-水泥联产,海水-淡水多用,盐-热-电联产生三大生态产业链流程图.
生态工业园区的建设,不仅仅是体现环保理念,重要依据循环经济理论和充分考虑经济的可持续发展,如图是某企业设计的硫酸-磷铵-水泥联产,海水-淡水多用,盐-热-电联产生三大生态产业链流程图.分析 (1)该产业链利用废热发电进行海水淡化、浓缩生成盐,而生成硫酸-磷肥-水泥联产的固体原料步运输,生成中需要大量的水,所以应建在沿海地区;
(2)根据流程图可知,①中冶炼钢铁的原料是Fe2O3,②中热电厂中向外提供的能量为电能,③利用沸腾炉中FeS2与氧气反应放出大量的热发电,④制硫酸时二氧化硫的循环利用,⑤硫酸工业中生成的硫酸,可用于制磷肥;
(3)沸炉中FeS2与氧气反应生成氧化铁和二氧化硫;普钙是磷酸二氢钙和硫酸钙,即硫酸与磷酸钙反应生成硫酸钙和磷酸二氢钙;
(4)热电厂的冷却水是海水,浓缩盐水提取盐(NaCl)后,剩余的苦卤中含有丰富的Mg元素、溴元素等;
(5)根据工厂的废气、废渣的成分分析并加以利用.
解答 解:(1)该产业链利用废热发电进行海水淡化、浓缩生成盐,而生成硫酸-磷肥-水泥联产的固体原料步运输,生成中需要大量的水,所以应建在沿海地区,故答案为:B;
(2)①中冶炼钢铁的原料是Fe2O3,②中热电厂中向外提供的能量为电能,③利用沸腾炉中FeS2与氧气反应放出大量的热发电,④制硫酸时二氧化硫的循环利用,⑤硫酸工业中生成的硫酸,可用于制磷肥,
故答案为:①Fe2O3;②电能;③热能;④SO2;⑤硫酸;
(3)沸炉中FeS2与氧气反应生成氧化铁和二氧化硫,反应方程式为:4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,普钙是磷酸二氢钙和硫酸钙,即硫酸与磷酸钙反应生成磷酸二氢钙和硫酸钙,其化学式为:Ca(H2PO4)、CaSO4,
故答案为:2SO2+O2$?_{△}^{催化剂}$2SO3;Ca(H2PO4)、CaSO4;
(4)热电厂的冷却水是海水,海水浓缩盐水提取盐(NaCl)后,剩余的苦卤中含有丰富的Mg元素、溴元素等,可以制取Mg或溴,
故答案为:海水;镁或溴;
(5)废气(主要是高炉煤气)经除尘后可作为热风炉、加热炉和锅炉等燃料;废渣(主要成分是硅酸钙等),可用作水泥生产原料,
故答案为:废气(主要是高炉煤气)经除尘后可作为热风炉、加热炉和锅炉等燃料;废渣(主要成分是硅酸钙等),可用作水泥生产原料.
点评 本题考查化学技术,涉及制工业炼铁、工业制备硫酸、水泥生产、磷肥工业、海水资源的综合利用、化学计算等,熟练掌握中学常见的化学工业,需要学生具备扎实的基础.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 增加HCl的浓度 | B. | 加水 | ||
| C. | 增加同浓度盐酸的体积 | D. | 增加压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

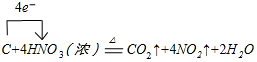 .
.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:CH3CH(OH)COOH+FeCO3+2H2O→[CH3CH(OH)COO]2Fe•3H2O+CO2↑.
乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,Mr=288)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:CH3CH(OH)COOH+FeCO3+2H2O→[CH3CH(OH)COO]2Fe•3H2O+CO2↑.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
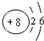 和
和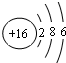 下列叙述正确的是( )
下列叙述正确的是( )| A. | A、B处于同一周期 | B. | A的非金属性比B弱 | ||
| C. | A的最高化合价等于B的最高化合价 | D. | A、B同处于VIA族 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com