
| A.反应①为氧化还原反应,反应②为复分解反应 |
| B.反应①中氧化产物与还原产物物质的量之比为2:9 |
| C.反应②的产物K2FeO4中Fe为+6价,具有强氧化性,能杀菌消毒 |
| D.若有2mol FeCl3发生反应,转移电子的物质的量为6 mol |


科目:高中化学 来源:不详 题型:填空题
 6CaSiO3+P4O10
6CaSiO3+P4O10 P4+10CO
P4+10CO C6H6O6+2H++2I-
C6H6O6+2H++2I- +I2
+I2 S4
S4 +2I-
+2I- +5S
+5S +2H+
+2H+ I2+5S
I2+5S +H2O
+H2O| | 0.01 mol/LKIO3酸性溶液(含淀粉)的体积/mL | 0.01 mol/LNa2SO3溶液的体积/mL | H2O的体积/mL | 实验温度/℃ | 溶液出现蓝色时所需时间/s |
| 实验1 | 5 | V1 | 35 | 25 | |
| 实验2 | 5 | 5 | 40 | 25 | |
| 实验3 | 5 | 5 | V2 | 0 | |
 Ce(OH)4↓+ 。
Ce(OH)4↓+ 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.MnO4-是氧化剂,Fe3+是还原产物 |
| B.Fe2+的还原性强于Mn2+ |
| C.取反应后的溶液加KSCN溶液,可观察到有血红色沉淀生成 |
| D.生成1mol水时,转移2.5mol电子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.S2- | B.S | C.SO32- | D.SO42- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.18 g | B.24 g | C.30 g | D.36 g |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1∶1混合的Pb3O4、PbO |
| B.1∶2混合的PbO2、Pb3O4 |
| C.1∶4∶1混合的PbO2、Pb3O4、PbO |
| D.4∶1∶1混合的PbO2、Pb3O4、PbO |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.5mol/L | B.1mol/L | C.1.2mol/L | D.2mol/L |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 HSO3- + H+的电离常数Ka= 1×10-2 mol/L,则该温度下NaHSO3的水解平衡常数Kh= mol/L,若向NaHSO3溶液中加入少量的I2,则溶液中
HSO3- + H+的电离常数Ka= 1×10-2 mol/L,则该温度下NaHSO3的水解平衡常数Kh= mol/L,若向NaHSO3溶液中加入少量的I2,则溶液中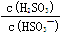 将 (填“增大”“减小”或“不变”,下同); 加入少量NaOH溶液,
将 (填“增大”“减小”或“不变”,下同); 加入少量NaOH溶液,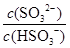 的值 ;加入少量水,水的电离程度将 。
的值 ;加入少量水,水的电离程度将 。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com