
| A. | ①②③ | B. | ①②④ | C. | ②③④⑤ | D. | ①②③④⑤ |
分析 ①非金属置换金属的反应,当气体和固体反应时可以发生;
②弱酸反应可以生成强酸,当有沉淀生成时可以发生;
③没有水生成,也没有沉淀和气体生成的复分解反应,发生络合反应符合这一要求;
④有单质参加的非氧化还原反应,如同素异形体间的转化;
⑤铜不能置换出氢气,铜和非氧化性的酸不反应,和强化性的酸反应不生成氢气.
解答 解:①非金属置换金属的反应,如氢气和氧化铜在加热的条件下反应生成铜和水,H2 +CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O,故①正确;
②弱酸反应可以生成强酸,如H2S+CuSO4═CuS↓+H2SO4 H2S是弱酸弱酸,而生成H2SO4是强酸强酸,能发生的原因是生成的CuS沉淀难溶于H2SO4,故②正确;
③没有水生成,也没有沉淀和气体生成的复分解反应,如 Fe3++3SCN-?Fe(SCN)3)硫氰化铁为血红色物质,既不是沉淀也不是气体,故③正确;
④有单质参加的非氧化还原反应,红磷和白磷是两种物质,当红磷转化成白磷时发生了化学反应,但单质转化成单质化合价没有发生改变,是非氧化还原反应,故④正确;
⑤铜和硝酸反应生成一氧化氮或二氧化氮气体,与浓硫酸反应生成二氧化硫气体,和稀硫酸不反应,但当铜作阳极,其它能导电的材料作阴极,稀硫酸作电解质,阳极铜溶解,阴极析出氢气,铜置换出氢气,故⑤正确;
故选D.
点评 本题考查了离子反应发生的条件,掌握规律、应用规律是解答的关键,题目难度不大.


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 16g CH4所含原子数目为NA | |
| B. | 1mol•L-1 NaCl溶液含有NA个Na+ | |
| C. | 常温常压下,22.4L CO2中含有NA个CO2分子 | |
| D. | 2.4g Mg与足量盐酸反应转移的电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
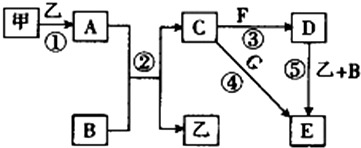
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向Fe(NO3)3溶液中通入SO2,滴加BaCl2溶液; 产生白色沉淀 | NO3-在酸性条件下能氧化SO2生成SO42- |
| B | 向Fe(NO3)2溶液中滴加少量盐酸; 浅绿色变深绿色 | 溶液中存在Fe2+水解平衡移动 |
| C | 向沸水中滴加FeCl3饱和溶液,煮沸得红褐色液体;用激光灯照射液体,有一条明亮“通路” | 该液体分散质直径介于1nm与100nm之间 |
| D | 向FeI2溶液中滴加酸化的双氧水和淀粉溶液;溶液为蓝色 | Fe2+的还原性比I-的还原性弱 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
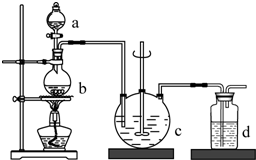 硫代硫酸钠(Na2S2O3),俗名海波、大苏打.通常为无色晶体,易溶于水,难溶于酒精,受热、遇酸易分解.医学上用于抢救氰化物中毒,常用于碘化法的测量.工业制备的反应原理为:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2,实验室模拟该工业过程的装置如图所示,回答下列问题:
硫代硫酸钠(Na2S2O3),俗名海波、大苏打.通常为无色晶体,易溶于水,难溶于酒精,受热、遇酸易分解.医学上用于抢救氰化物中毒,常用于碘化法的测量.工业制备的反应原理为:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2,实验室模拟该工业过程的装置如图所示,回答下列问题:| 实验序号 | 1 | 2 | 3 |
| Na2S2O3溶液体积(mL) | 19.98 | 20.02 | 21.18 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两原子N层上都有1个s电子,一个原子有d电子,另一个原子无d电子 | |
| B. | 最外层电子排布为2s22p6的原子和最外层电子排布为2s22p6的离子 | |
| C. | 原子核外M层上的s、p轨道都充满电子,而d轨道上没有电子的两种原子 | |
| D. | 两原子的核外全部都是s电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 汽车尾气、工业废气的排放是形成“雾霾”的主要原因 | |
| B. | 用铝制容器盛放浓硫酸,是因为铝和浓硫酸不反应 | |
| C. | 不锈钢比普通钢抗腐蚀能力强,是因为表面镀了一层铬 | |
| D. | “辽宁舰”用于舰载机降落阻拦索的是一种特种钢缆,属于新型无机非金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,有机物 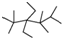 的命名为2,3,3,5,5五甲基-4,4-二乙基己烷 的命名为2,3,3,5,5五甲基-4,4-二乙基己烷 | |
| B. |  主链上的碳原子数是5 主链上的碳原子数是5 | |
| C. | 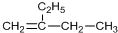 加氢后可以得到3-甲基戊烷 加氢后可以得到3-甲基戊烷 | |
| D. |  的名称是1,3,4-三甲基苯 的名称是1,3,4-三甲基苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
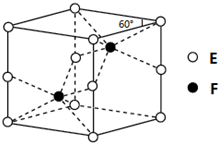 A、B、C、D、E、F为元素周期表前四周期的元素,原子序数依次增大.A元素的单质是空气的主要成分,B原子核外p轨道上有1对成对电子,D元素的价电子数是其余电子数的一半,C与B同主族,A与F同主族,D与E同族.回答下列问题:
A、B、C、D、E、F为元素周期表前四周期的元素,原子序数依次增大.A元素的单质是空气的主要成分,B原子核外p轨道上有1对成对电子,D元素的价电子数是其余电子数的一半,C与B同主族,A与F同主族,D与E同族.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com