
【题目】研究燃煤烟气的脱硫(除SO2)和脱硝(除NOx)具有重要意义,请回答下列问题。
(1)采用低温臭氧氧化脱硫脱硝技术,同时吸收SO2和NOx,获得(NH4)2SO4的稀溶液。已知常温下,该溶液的pH=5,则![]() =_________(该温度下NH3· H2O的Kb=1.7×10-5)。往(NH4)2SO4溶液中再加入少量(NH4)2SO4固体,
=_________(该温度下NH3· H2O的Kb=1.7×10-5)。往(NH4)2SO4溶液中再加入少量(NH4)2SO4固体,![]() 的值将________(填“变大”、“不变”或“变小”)。
的值将________(填“变大”、“不变”或“变小”)。
(2)用乙烯作为还原剂将氮的氧化物还原为N2的脱硝技术,其脱硝机理示意图如下图1,脱硝率与温度,负载率(分子筛中催化剂的质量分数)的关系如图2所示。
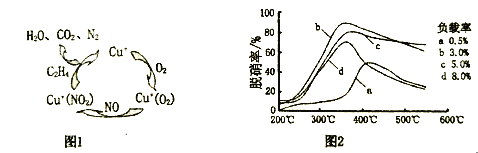
①写出该脱硝过程中乙烯和NO2反应的化学方程式:___________________。
②要达到最佳脱硝效果,应采取的条件是:___________________。
(3)利用如图装置可实现用Na2SO4溶液吸收SO2,再用离子膜电解法电解吸收液得到单质硫。
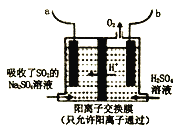
①a端应连接电源的_____(填“正极”或“负极”)。
②用Na2SO4溶液代替水吸收烟气中的SO2使之转化为H2SO3,其目的是_______________。
③电解过程中,阴极的电极反应式为______________。
【答案】1.7×104 变大 2C2H4+6NO2=4CO2+3N2+4H2O 350℃(或340℃—360℃)、负载率3% 负极 提高溶液导电性,加快电解速率 SO2+4H++4e-=S+2H2O
【解析】
(1) pH=5,则c(OH-)=10-9mol/L,利用一水合氨的电离平衡常数计算![]() ;
;
(NH4)2SO4是强酸弱碱盐,在溶液中NH4+发生水解反应,根据浓度与盐水解反应关系判断![]() 的变化;
的变化;
(2)①在该脱硝过程中乙烯和NO2反应生成N2、CO2和水,根据电子守恒、原子守恒可得化学方程式:2C2H4+6NO2=4CO2+3N2+4H2O;
②脱硝率高,负载率低,适宜的温度;
(3)①根据H+移动方向判断电极的正负;
②用Na2SO4溶液吸收SO2气体,Na2SO4是电解质,可从增强溶液的导电性分析;
③电解过程中,阴极上SO2获得电子,发生还原反应,可根据示意图分析书写电极反应式。据此进行解答。
(1)pH=5,则c(H+)=10-5mol/L,根据Kw=10-14mol2/L2可得c(OH-)=10-9mol/L,NH3· H2O的Kb=![]() 1.7×10-5,则
1.7×10-5,则![]() =
=![]() =1.7×104;
=1.7×104;
(NH4)2SO4是强酸弱碱盐,在溶液中NH4+发生水解反应,NH4++H2O![]() NH3H2O+H+,使溶液显酸性,由于向该溶液中加入固体(NH4)2SO4时,c(NH4+)、c(SO42-)都增大,由于加入NH4+时,平衡正向移动,但平衡移动的趋势是微弱的,总的来说c(NH4+)占总浓度的比是增大,所以溶液
NH3H2O+H+,使溶液显酸性,由于向该溶液中加入固体(NH4)2SO4时,c(NH4+)、c(SO42-)都增大,由于加入NH4+时,平衡正向移动,但平衡移动的趋势是微弱的,总的来说c(NH4+)占总浓度的比是增大,所以溶液![]() 增大;
增大;
(2)①在该脱硝过程中乙烯和NO2反应生成N2、CO2和水,根据电子守恒、原子守恒可得化学方程式:
②要达到最佳脱硝效果,脱硝率高,负载率低,温度适宜,根据图示可知适合条件为350℃、负载率3%。
(3)①H+是阳离子,根据异种电荷相互吸引的原则可知左边电极为阴极,连接电源的负极;
②用电解方法吸收SO2气体,SO2被还原为S单质,Na2SO4是可溶性盐,是强电解质,在溶液中完全电离产生自由移动的离子,因此可增强溶液的导电性,从而可加快反应速率;
③中电解过程中,阴极上SO2获得电子,发生还原反应,该电极的反应式是SO2+4H++4e-=S+2H2O。


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案科目:高中化学 来源: 题型:
【题目】M、N、O、P、Q是元素周期表中原子序数依次递增的前四周期元素.M原子最外层电子数为内层电子数的3倍;N的焰色反应呈黄色;O的氢化物是一种强酸,其浓溶液可与M、Q的化合物反应生成O的单质;P是一种金属元素,其基态原子中有6个未成对电子.请回答下列问题:
(1)元素Q的名称为______________,P的基态原子价层电子排布式为__________________。
(2)O的氢化物的沸点比其上一周期同族元素的氢化物低,是因为___________________。
(3)M、O电负性大小顺序是__________(用元素符号表示),O的最高价含氧酸根的空间构型为_____________,其中心原子的杂化类型为_______________。
(4)M、N形成的化合物的晶胞如图所示,该晶胞的化学式为__________________,其中M离子的配位数为_____________,该晶体类型为____________________。
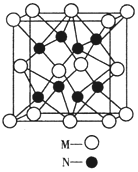
(5)该晶胞的边长为 a pm,则该晶体的密度为____________________g/cm3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A.标准状况下,22.4 L三氧化硫中含有的分子数为NA
B.0.5 mol·L-1的Na2SO4溶液中,含有Na+的个数为NA
C.标准状况下,22.4L二氧化硫与22.4L氧气所含的原子总数均为2NA
D.32 g 氧气所含的氧原子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据量子力学计算,氮化碳结构有五种,其中一种β-氮化碳硬度超过金刚石晶体,成为首屈一指的超硬新材料,已知该氮化碳的二维晶体结构如图所示。下列有关氮化碳的说法不正确的是

A. 该晶体中的碳、氮原子核外都满足8电子稳定结构
B. 氮化碳中碳显+4价,氮显-3价
C. 每个碳原子与四个氮原子相连,每个氮原子和三个碳原子相连
D. 氮化碳的分子式为C3N4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有m g某气体,它的摩尔质量为M g·mol-1。若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为________mol。
(2)该气体在标况下的密度为__________g/L。
(3)该气体在标准状况下的体积为____________L。
(4)该气体溶于0.1L水中(水的密度:1g·mL-1,且不考虑反应),其溶液中溶质的质量分数为_____。
(5)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为_____mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E是化学中常见的物质,常温下,E是一种无色无味的液体,它们之间有如下反应关系。
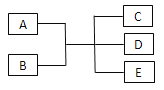
(1)若A是一种红色金属单质,B是一种常见的挥发性酸,反应时生成的C是无色气体,反应的离子方程式为___________,若反应放出1.12 L气体(标准状况下),则被还原的B物质的量为___________mol。
(2)若实验室中利用固体A和B的反应制备气体C,C是一种无色、刺激性气味、密度比空气小、碱性的气体,试写出此反应的化学方程式________________;实验室检验C的方法为_______________。
(3)若B是黄绿色有毒气体,上述关系经常用于实验室尾气处理,则反应的离子方程式为________________。若用湿润的淀粉碘化钾试纸靠近盛满B的试管口,看到的现象为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为氢氧燃料电池装置示意图,下列有关说法正确的是( )
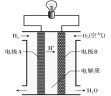
A. 电极A为正极
B. 产物为水,属于环境友好电池
C. 电子流向:电极B→导线→电极A
D. 该电池的化学能可以100%转化为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)15.6g Na2X中含Na+ 0.4mol,则Na2X的摩尔质量是____________。
(2)设NA为阿伏加德罗常数的数值,如果a g氧气中含有的分子数为b,则c g氧气在标准状况下的体积约是_________________(用含NA的式子表示)。
(3)标况下,密度为1.25g/L的CO2与CH4组成的混合气体中,CO2的体积分数为______。
(4)下列各项与胶体性质无关的有______________________。
①卤水点豆腐 ②明矾净水 ③静电除尘 ④油水分离 ⑤血液透析 ⑥三角洲形成 ⑦酸碱中和 ⑧雨后彩虹和海市蜃楼 ⑨臭氧消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应m A(s) + n B(g) ![]() p C(g) + q D(g) 反应过程中,当其它条件不变时,C的质量分数与温度(T)和压强(P)的关系如图,根据图中曲线分析,下列叙述中正确的是
p C(g) + q D(g) 反应过程中,当其它条件不变时,C的质量分数与温度(T)和压强(P)的关系如图,根据图中曲线分析,下列叙述中正确的是
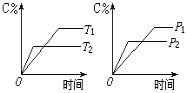
A. 平衡后,增大A的量,有利于平衡向正反应方向移动
B. 平衡后,若升高温度,平衡则向逆反应方向移动
C. 到达平衡后,若使用催化剂,C的质量分数增大
D. 化学方程式中一定n > p+q
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com