
分析 根据n=$\frac{N}{{N}_{A}}$计算水的物质的量,每个水分子中含有3个原子,据此计算水中原子的物质的量;每个水分子中含有10个电子,据此计算电子的物质的量.
解答 解:n(H2O)=$\frac{N}{{N}_{A}}$=$\frac{3.01×1{0}^{23}}{6.02×1{0}^{23}/mol}$=0.5mol,每个水分子中含有3个原子,水中原子的物质的量=3n(H2O)=3×0.5mol=1.5mol;每个水分子中含有10个电子,则电子的物质的量=10×0.5mol=5mol,
故答案为:0.5;1.5;5.
点评 本题考查物质的量有关计算,为高频考点,侧重考查学生计算能力,明确物质的量公式中各个物理量之间的关系式即可解答,题目难度不大.


科目:高中化学 来源: 题型:选择题

| A. | 升高温度,同时增大压强 | |
| B. | 降低温度.同时减小压强 | |
| C. | 增大反应物的浓度,同时使用适宜的催化剂 | |
| D. | 增大反应物的浓度,同时减小生成物的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用pH试纸测得新制氯水的pH为2 | |
| B. | 中和滴定实验中,滴定管内液面对应的刻度由0 mL变为10 mL | |
| C. | 某同学在托盘天平左盘放置5g砝码,游码位于0.5g处,则所得药品质量为5.5g | |
| D. | 质量分数为20%的NaCl溶液与水等质量混合,稀释后溶液的质量分数必为10% |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | H2O既不是氧化产物也不是还原产物 | |
| B. | 该反应中被氧化和被还原的氮元素的质量比是3:2 | |
| C. | 若有2mol NH3完全反应,共转移12mol电子 | |
| D. | NO是氧化剂,NH3是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
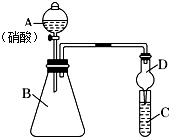 学习了元素周期律的有关知识后,某同学根据元素非金属性与对应最高价含氧酸之间的关系,选择由短周期元素组成的化合物设计了如图1装置来一次性完成同主族和同周期元素非金属性强弱比较的实验研究.
学习了元素周期律的有关知识后,某同学根据元素非金属性与对应最高价含氧酸之间的关系,选择由短周期元素组成的化合物设计了如图1装置来一次性完成同主族和同周期元素非金属性强弱比较的实验研究.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0:1:12:11 | B. | 14:13:12:11 | C. | 14:13:2:3 | D. | 1:10:100:1000 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室需要0.1mol/LNaOH溶液500mL,根据这种溶液的配制情况回答下列问题.
实验室需要0.1mol/LNaOH溶液500mL,根据这种溶液的配制情况回答下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com