
![]() 已知A~E均为中学化学常见物质,转换关系如图,其中A、B、C、E均可形成原子晶体,B、E为非金属单质,C是汽车尾气中的污染物之一。
已知A~E均为中学化学常见物质,转换关系如图,其中A、B、C、E均可形成原子晶体,B、E为非金属单质,C是汽车尾气中的污染物之一。
(1)反应②中,氧化剂和还原剂的质量比: 。
(2)B、D、E形成原子晶体的熔点由高到低的顺序是 。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
 已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).
已知A、B、D、E均为中学化学常见单质或化合物,它们之间的关系如图所示(部分产物略去).查看答案和解析>>
科目:高中化学 来源: 题型:

(1)若A和E为单质,组成A单质的元素是自然界中形成化合物种类最多的元素。
①B属于_________分子(填“极性”或“非极性”),B分子中各原子最外层_________(填“是”或“否”)都满足8电子结构;
②向50 mL 4 mol·L-1的NaOH溶液中通入
③
(2)若A为第三周期中的元素所形成的氯化物。
①写出A溶液B的离子方程式_________________________;
②写出A和B的溶液反应的离子方程式________________________。
(3)若A为常见的金属,在E的冷、浓溶液中,A有钝化现象。已知:X为含有非极性键的离子化合物,且1 mol X含有38 mol电子,向D溶液中加入与D等物质的量的X固体,恰好完全反应,写出该反应的离子方程式________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B、D、E均为中学化学常见单质或化合物,它们之间的转换关系如下图所示(部分产物略去)。
(1)若A为单质,组成A单质的元素是自然界中形成化合物种类最多的元素。
①B属于 分子(填“极性”或“非极性”),B分子中所有原子是否都满足8电子结构, (填“是”或“否”)。
②向50 mL 4 mol/L的NaOH溶液中通入1.12 L B(标准状况),反应后溶液中的溶质为_______(填化学式),物质的量分别为_____________。
(2)若A为第三周期中的元素所形成的氯化物。
①写出A溶液→B的离子方程式 。
②写出A和B在溶液中反应的离子方程式 。
(3)若A为常见的金属,在E的冷、浓溶液中有钝化现象。已知:X为含有非极性键的离子化合物,且1 mol X含有38mol电子,向D溶液中加入与D等物质的量的固体X,该反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2010年黑龙江省哈三中高三上学期10月月考化学试题 题型:填空题
已知A、B、D、E均为中学化学常见单质或化合物,它们之间的转换关系如下图所示(部分产物略去)。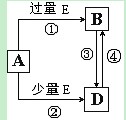
(1)若A为单质,组成A单质的元素是自然界中形成化合物种类最多的元素。
①B属于 分子(填“极性”或“非极性”),B分子中所有原子是否都满足8电子结构, (填“是”或“否”)。
②向50 mL 4 mol/L的NaOH溶液中通入1.12 L B(标准状况),反应后溶液中的溶质为_______(填化学式),物质的量分别为_____________。
(2)若A为第三周期中的元素所形成的氯化物。
①写出A溶液→B的离子方程式 。
②写出A和B在溶液中反应的离子方程式 。
(3)若A为常见的金属,在E的冷、浓溶液中有钝化现象。已知:X为含有非极性键的离子化合物,且1 mol X含有38 mol电子,向D溶液中加入与D等物质的量的固体X,该反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2013届山西省高二5月月考化学试卷(解析版) 题型:填空题
已知A、B、C、D、E均为中学化学中常见物质,在一定条件下相互转化关系如下图所示(反应条件和部分产物已省略)。
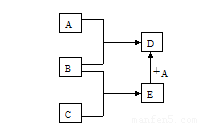
①A常温下为黄绿色的气体单质。
②B为一种常见变价金属单质,在冷的浓硫酸中会被钝化。
③C的水溶液是一种无氧酸,且C的组成中含有与A相同的元素。
请回答:(1) A的化学式为 ,构成非金属单质A的元素的最高价氧化物的分子式为 ,C的名称为 。
(2)A与水反应的化学方程式为 。
(3)A与E反应生成D的离子方程式为 。
(4)在E的水溶液中加入足量氢氧化钠溶液,观察到的现象为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com