
A.HF、HCl、HBr、HI的热稳定性依次减弱
B.Na、Mg、Al的硬度依次增大
C.NaF、NaCl、NaBr、NaI的熔点依次降低
D.F2、Cl2、Br2、I2的熔、沸点逐渐升高
 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:
| 氢化物 | A | B | C | D | E |
| 沸点/℃ | 1317 | 100 | 19.5 | -33 | -162 |
查看答案和解析>>
科目:高中化学 来源: 题型:
元素周期表是学习物质结构和性质的重要工具,元素周期律反映了元素性质的周期性变化规律。
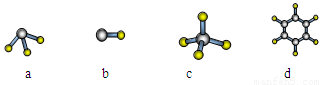
(1)元素A的原子最外层电子排布式为nsnnpn,该原子最外层共有 种不同运动状态的电子,该原子核外共有 种能量不同的电子。元素A与氢元素形成的分子,其空间结构可能是(填序号) 。
(2)下列变化规律中正确的是 。
A.金属K、Na、Mg的熔沸点由低到高
B.C1-、Br-、I-的失电子能力由弱到强
C.H+、Li+、H-的半径由大到小
D.H3PO4、HClO4、H2SO4的酸性由弱到强
(3)第二周期元素中,除Be、B、Ne三种元素外,其他元素的氢化物沸点如下表所示,其中A的电子式为 ,E的化学式为 。
| 氢化物 | A | B | HF | D | E |
| 沸点/℃ | 1317 | 100 | 19.5 | 33 | 164 |
查看答案和解析>>
科目:高中化学 来源:2010-2011学年上海市闸北区高三上学期期末考试化学试卷 题型:填空题
元素周期表是学习物质结构和性质的重要工具,元素周期律反映了元素性质的周期性变化规律。
(1)元素A的原子最外层电子排布式为nsnnpn,该原子最外层共有 种不同运动状态的电子,该原子核外共有 种能量不同的电子。元素A与氢元素形成的分子,其空间结构可能是(填序号) 。
(2)下列变化规律中正确的是 。
A.金属K、Na、Mg的熔沸点由低到高
B.C1-、Br-、I-的失电子能力由弱到强
C.H+、Li+、H-的半径由大到小
D.H3PO4、HClO4、H2SO4的酸性由弱到强
(3)第二周期元素中,除Be、B、Ne三种元素外,其他元素的氢化物沸点如下表所示,其中A的电子式为 ,E的化学式为 。
|
氢化物 |
A |
B |
HF |
D |
E |
|
沸点/℃ |
1317 |
100 |
19.5 |
33 |
164 |
查看答案和解析>>
科目:高中化学 来源:2010年重庆巫山高级中学高三上学期开学考试化学试题 题型:填空题
元素周期表反映了元素性质的周期性变化规律。请根据短周期元素在周期表中的位置、结构和相关性质,回答下列问题:
(1)第VIA族元素形成的氢化物中沸点最高的是____________(用分子式表示),原因是____________________,该分子的空间构型为______________。
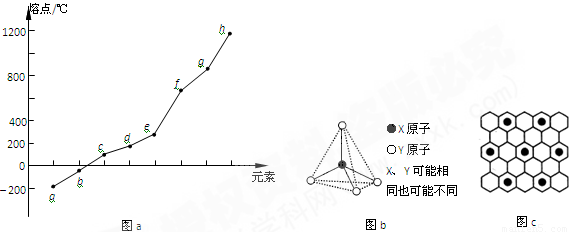
(2)第二周期元素中,除Be、B、Ne三种元素外,其他元素的氢化物沸点如表1所示,其中E的化学式为 ;第三周期元素单质的熔点(℃)变化如图a所示,其中h的元素符号为 。 (表1)
|
氢化物 |
A |
B |
HF |
D |
E |
|
沸点/℃ |
1317 |
100 |
19.5 |
33.35 |
164 |
(3)第二、第三周期的某些元素能形成单质甲和化合物乙,它们具有图b所示的结构单元,甲和乙的晶体类型相同,甲的某种同素异形体与乙在高温时能发生置换反应生成h的单质和CO。若该反应生成的h的单质含有1 mol共价键,则参加反应的乙的质量为_______________g。
(4)碳元素的某种单质具有平面层状结构,该单质的名称为__________;同一层中的原子构成许多的正六边形,单质与熔融的钾相互作用,形成某种青铜色的物质(其中的元素钾用“●”表示),原子分布如图c所示,该物质的化学式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com