
【题目】实验室制取硝基苯的主要步骤如下:
①配制一定比例的浓硫酸和浓硝酸的混合液,加入反应器。
②向室温下的混合酸中逐滴加入一定量的苯,充分振荡,混合均匀。
③在50~60℃下发生反应,直到反应结束。
④除去混合酸后,粗产品依次用蒸馏水和5%NaOH溶液洗涤,最后再用蒸馏水洗涤。
⑤将用无水CaCl2干燥后的粗硝基苯进行蒸馏得到纯硝基苯。
填写下列空白:
(1)配制一定比例的浓硫酸和浓硝酸的混合酸时,操作注意事项是
。
(2)步骤③中,为了使反应在50~60℃下进行,常用的方法是 。
(3)步骤④中洗涤、分离粗硝基苯使用的仪器是 。
(4)步骤④中粗产品用5%NaOH溶液洗涤的目的是 。
(5)实验室制取硝基苯化学方程式 。
【答案】(1)先将浓硝酸注入容器中,再慢慢注入浓硫酸,并及时搅拌和冷却
(2)将反应器放在50~60℃(或回答60℃)的水浴中加热
(3)分液漏斗
(4)除去粗产品中残留的酸(或回答除去残留的硝酸,硫酸)
(5)![]()
【解析】
试题分析:(1)浓硫酸密度大于浓硝酸,浓硫酸与浓硝酸混合放出大量的热,所以配制混酸操作的注意事项是:先将浓硝酸注入容器中,再慢慢注入浓硫酸,并及时搅拌和冷却;
故答案为:先将浓硝酸注入容器中,再慢慢注入浓硫酸,并及时搅拌和冷却;
(2)由于反应物的量不是很多,加热时温度变化幅度较大,为了能有效的控制反应在50℃~60℃下进行,需要将反应器放在50~60℃的水浴中加热。
故答案为:将反应器放在50~60℃(或回答60℃)的水浴中加热;
(3)分离互不相溶的液体采用分液方法分离,使用的仪器是分液漏斗。
故答案为:分液漏斗;
(4)氢氧化钠溶液具有碱性,能中和未反应的酸,所以氢氧化钠的作用是洗去粗产品中未反应的酸性杂
质。
故答案为:除去粗产品中残留的酸(或回答除去残留的硝酸、硫酸);
(5)实验室制取硝基苯的反应,是苯和硝酸的取代反应,化学方程式为:
![]() 。
。
故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究铜跟浓硫酸反应,用下图装置进行有关实验。请回答下列问题:
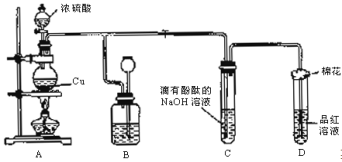
(1)装置A中发生的化学反应的化学方程式为 ;
(2)装置B的作用是贮存多余的气体,B中广口瓶内应盛放的液体是 (填序号);
①水 ②酸性KMnO4 ③Na2CO3溶液 ④饱和的NaHSO3溶液
(3)装置C和D中产生的现象相同,但原因却不同。C中是由于SO2 ,而D中则是由于SO2具有 ;
(4)装置D中试管口塞一团棉花,棉花中应浸有一种液体,其作用是 ;
(5)实验完毕,待A中烧瓶内液体冷却后,过滤,向滤液中加入少量的蒸馏水稀释,溶液为蓝色,为了证明蓝色只与Cu2+有关,而与其它离子无关,某同学设计了下列实验,其中对实验目的没有意义的是 (填序号);
①观察稀H2SO4溶液呈无色
②观察CuSO4粉末呈白色
③稀释CuSO4溶液,溶液蓝色变浅
④往CuSO4溶液中加入足量NaOH溶液,生成蓝色沉淀,过滤,滤液呈无色
⑤往CuSO4溶液中加入足量BaCl2的溶液,生成白色沉淀,过滤,滤液仍显蓝色
(6)若实验中用7.2g铜片和12.5mL18.0ml·L-1的浓硫酸在加热条件充分反应,最终铜片仍有剩余。根据所学的知识,某同学认为溶液中一定还有硫酸剩余,其理由是 。
假定反应前后溶液的体积不变,设剩余硫酸的浓度为amol/L,现向反应后溶液中缓慢加入硝酸钾固体,充分搅拌直到剩余铜片恰好完全反应,反应消耗硝酸钾 mol(用含a的代数式表示,要化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确是的( )
A.CH2(OH)CH2OH和乙醇是同系物
B.正丁烷与异丁烷互为同分异构体,金刚石与石墨也是
C.丙烯与水加成有2种同分异构体产物
D.SiO2既可以和NaOH溶液反应,又可以与氢氟酸反应,所以其为两性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于酯化反应说法正确的是( )
A.用CH3CH218OH与CH3COOH发生酯化反应,生成H218O
B.反应液混合时,顺序为先倒乙醇再倒浓硫酸最后倒乙酸
C.乙酸乙酯不会和水生成乙酸和乙醇
D.用蒸馏的方法从饱和Na2CO3溶液中分离出乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据反应:2H2S+O2=2S↓+2H2O,Na2S+I2=2NaI+S↓
4NaI+O2+2H2SO4=2I2+2Na2SO4+2H2O,下列物质的氧化性强弱判断正确的是
A.H2O>NaI>H2S B.H2S>NaI>H2O C.S>I2>O2 D.O2>I2>S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】—硝基甲苯是一种重要的工业原料,某化学学习小组设计如图所示装置制备一硝基甲苯(包括对硝基甲苯和邻硝基甲苯)
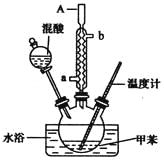
实验步骤如下:
①配制浓硫酸和浓硝酸的混合物(混酸);
②在三颈烧瓶里装15 mL甲苯(密度为0.866 g·cm-3);
③装好其他药品,并组装好仪器;
④向三颈烧瓶中加入混酸,并不断搅拌;
⑤控制温度,大约反应10分钟至三颈烧瓶底有大量液体(淡黄色油状)出现;
⑥分离出一硝基甲苯,经提纯最终得到一硝基甲苯共15 g.
根据上述实验,回答下列问题:
(1)本实验的关键是控制温度在30℃左右,如果温度过高,则会产生__________等副产品(填物质名称)
(2)简述配制混酸的方法:____________________.
(3)A仪器名称是__________,进水口是__________.
(4)写出甲苯与混酸反应生成对硝基甲苯的化学方程式:___________________________.
(5)分离产品方案如下:
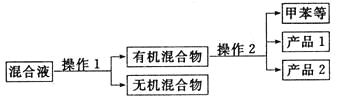
操作2的名称是___________.经测定,产品2的核磁共振氢谱中有5个峰,它的名称为___________.
(6)本实验中一硝基甲苯的产率为___________ (结果保留三位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A.氢气、石油、煤、油脂都属于化石燃料
B.蔗糖及其水解产物均可发生银镜反应
C.分子式为(C6H10O5)n的淀粉和纤维素互为同分异构体
D.油脂在碱性条件下的水解反应又称为皂化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)硼位于ⅢA族,三卤化硼是物质结构化学的研究热点,也是重要的化工原料。三氯化硼(BCl3)可用于制取乙硼烷(B2H6),也可作有机合成的催化剂。
【查阅资料】
①BCl3的熔点为-107.3 ℃,沸点为12.5 ℃;
②2B+6HCl![]() 2BCl3↑+3H2↑;
2BCl3↑+3H2↑;
③硼与铝的性质相似,也能与氢氧化钠溶液反应。
【设计实验】 某同学设计如图所示装置制备三氯化硼:
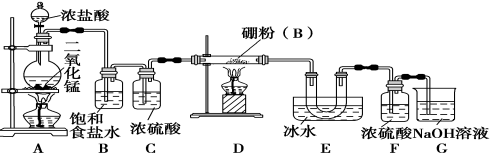
请回答下列问题:
(1)常温下,高锰酸钾固体粉末与浓盐酸发生的反应可替代A装置中的反应,两个反应的产物中锰的价态相同。写出高锰酸钾固体粉末与浓盐酸反应的离子方程式:______________。
(2)E装置的作用是________________。
(3)写出D装置中发生反应的化学方程式:__________________;实验中可以用一个盛装________(填试剂名称)的干燥管代替F+G装置,使实验更简便。
(4)三氯化硼遇水剧烈反应生成硼酸(H3BO3)和白雾,写出该反应的化学方程式________________。
(5)为了顺利完成实验,正确的操作是__________(填序号)。
①先点燃A处酒精灯,后点燃D处酒精灯
②先点燃D处酒精灯,后点燃A处酒精灯
③同时点燃A、D处酒精灯
(6)请你设计一个简易实验,验证制得的产品中是否含有硼粉:____________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com