
| A. | A的平均反应速率为0.1mol/(L•min) | |
| B. | 平衡时,B的转化率为20% | |
| C. | 平衡时,C的浓度为0.125 mol/L | |
| D. | 平衡时,容器内的压强为原来的0.875倍 |
分析 5min后反应达到平衡,容器内压强变小,则有x+2<3+1,x<2,只能为x=1,D的平均反应速率为0.1mol/(L•min),生成n(D)=2L×5min×0.1mol/(L•min)=1mol,则:
3A(g)+B(g)?C(g)+2D(g)
起始(mol):3 2.5 0 0
转化(mol):1.5 0.5 0.5 1
平衡(mol):1.5 2 0.5 1
以此解答该题.
解答 解:5min后反应达到平衡,容器内压强变小,则有x+2<3+1,x<2,只能为x=1,D的平均反应速率为0.1mol/(L•min),生成n(D)=2L×5min×0.1mol/(L•min)=1mol,则:
3A(g)+B(g)?C(g)+2D(g)
起始(mol):3 2.5 0 0
转化(mol):1.5 0.5 0.5 1
平衡(mol):1.5 2 0.5 1
A.v(A)=$\frac{\frac{1.5mol}{2L}}{5min}$=0.15mol/(L•min),故A错误;
B.B的转化率为$\frac{0.5}{2.5}×100%$=20%,故B正确;
C.平衡时,C的浓度为$\frac{0.5mol}{2L}$=0.25mol/L,故C错误;
D.恒温恒容下,压强之比对物质的量之比,容器内的起始压强和平衡压强之比为(1.5+2+0.5+1)mol:(3+2.5)mol=10:11,器内的压强为原来的0.91倍,故D错误.
故选B.
点评 本题考查化学平衡的计算,为高频考点,侧重考查学生的分析能力和计算能力,难度不大,关键是确定x的值,注意掌握三段式法在化学平衡计算中应用.


科目:高中化学 来源: 题型:填空题
 和
和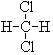 ; ⑦CH3 (CH2) 3CH3和
; ⑦CH3 (CH2) 3CH3和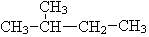
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
 |  |  |  |
| 铁叉镀镍 | 组成原电池并产生明显电流 | 电解法制铝 | 准确量取一定体积K2Cr2O7标准溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(NO2)═2V(N2O4) | B. | 容器内的压强不变时 | ||
| C. | 容器中c(NO2)═c(N2O4)时 | D. | 容器中气体的总质量保持不变时 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 甲<乙<丙<丁 | B. | 丁<甲<乙=丙 | C. | 甲=丁<乙=丙 | D. | 丁<甲<乙<丙 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 46g乙醇分子中含有极性键的数目为6NA | |
| B. | 分子数为NA的CO、C2H4混合气体体积为22.4L,质量为28g | |
| C. | $\frac{1}{18}$mol的H35Cl分子所含中子数为NA | |
| D. | 加热条件下,1molH2与1molI2混合,该反应过程中转移的电子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 无水乙醇与浓H2SO4共热至170℃,将产生的气体依次通入足量NaOH溶液和酸性KMnO4溶液 | 红色褪去 | 有乙烯生成 |
| B | 取少量溴乙烷与NaOH溶液反应后的上层液体,滴入AgNO3溶液 | 出现褐色沉淀 | 溴乙烷与NaOH溶液未发生取代反应 |
| C | 麦芽糖溶液与新制的氢氧化铜悬浊液共热 | 出现砖红色沉淀 | 麦芽糖中含有醛基 |
| D | 将大小相同的钠块分别放入等体积的蒸馏水和乙醇中 | 水中的反应更剧烈 | 分子中羟基的活泼性:水>乙醇 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com