
X、Y是元素周期表中ⅦA族的两种元素,下列能说明X的非金属性比Y强的是( )。
A.电子层数:X>Y B.气态氢化物的稳定性:HX<HY
C.酸性:HXO4>HYO4 D.能发生置换反应:Y2+2NaX=X2+2NaY
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
(1)(3)]光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
(1)实验室中常用来制备氯气的化学方程式为_________________________________。
(3)实验室中可用氯仿(CHCl3)与双氧水直接反应制备光气,其反应的化学方程式为________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某一溴代烷水解后的产物在红热铜丝催化下, 最多可被空气氧化生成4种不同的醛,该一溴代烷的分子式可能是
A.C4H9Br B.C5H11Br C.C6H13Br D.C7H15Br
查看答案和解析>>
科目:高中化学 来源: 题型:
据报道,最近摩托罗拉(MOTOROLA)公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量是现用镍氢电池和锂电池的10倍,可连续使用1个月才充电一次。假定放电过程中,甲醇完全氧化产生的CO2被充分吸收生成CO32-。
(1)该电池反应的总离子方程为 ;
(2)甲醇在 极(填“正”或“负”)发生反应,电池在放电过程中溶液的pH将 (填“下降”或“上升”、“不变”);若有16克甲醇蒸汽被完全氧化产生电能,并利用该过程中释放的电能电解足量的CuSO4溶液,(假设整个过程中能量总利用率为80%),则将产生标准状况下的O2 升。
(3)最近,又有科学家制造出一种使用固体电解质的燃料电池,其效率更高。一个电极通入空气,另一个电极通入天然气。其中固体电解质是掺杂了Y2O3(Y:钇)的ZrO2(Zr:锆)固体,它在高温下能传导O2-离子(其中氧化反应发生完全)。以甲烷(CH4)代表汽油。
①电池的正极反应式为 ;
②放电时固体电解质里的O2-离子的移动方向是向 极移动(填“正”或“负”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于浓硝酸和浓硫酸的叙述正确的是( )
A.都是常用的干燥剂
B.常温下都能与氢前金属反应放出氢气
C.一定条件下和铜反应中都表现出强氧化性和强酸性
D.分别露置在空气中,容器内溶质的物质的量浓度都增大
查看答案和解析>>
科目:高中化学 来源: 题型:
化学反应A2+B2=2AB的能量变化如图所示。下列说法正确的是( )
A.该反应是吸热反应
B.断裂1molA-A键和1mol B-B键放出xkJ能量
C.断裂2molA-B键需要吸收ykJ能量
D.2molAB的总能量高于1mol A2和1mol B2的总能量

查看答案和解析>>
科目:高中化学 来源: 题型:
单晶硅是信息产业中重要的基础材料。通常用炭在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室用粗硅制备四氯化硅的装置示意图。

相关信息如下:①四氯化硅遇水极易水解;
②硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
③有关物质的物理常数见下表:
| 物质 | SiCl4 | BCl3 | AlCl3 | FeCl3 | PCl5 |
| 沸点/℃ | 57.7 | 12.8 | — | 315 | — |
| 熔点/℃ | -70.0 | -107.2 | — | — | — |
| 升华温度/℃ | — | — | 180 | 300 | 162 |
请回答下列问题:
(1)写出装置A中发生反应的离子方程式 。
(2)装置A中仪器g的名称是 ;装置C中的试剂是 ;
(3)从安全角度考虑,若将装置E中通入h瓶的粗玻璃导气管换成细玻璃导气管,可能带来的后果是 。
(4)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是 (填写元素符号)。
(5)为分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:
5Fe2++MnO4-+8H+ 5Fe3++Mn2++4H2O
5Fe3++Mn2++4H2O
①滴定前是否要滴加指示剂? (填“是”或“否”),判断达到滴定终点的现象是 。
②某同学称取5.000g残留物后,经预处理后在容量瓶中配制成100 mL溶液,移取25.00mL试样溶液,用1.000×10-2 mol/L KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00 mL,则残留物中铁元素的质量分数是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。
(1)工业上用黄铁矿(FeS2,其中硫元素为-1价)在高温下和氧气反应制备SO2:4FeS2+11O2 8SO2+2Fe2O3,该反应中被氧化的元素是________(填元素符号)。当该反应转移2.75 mol电子时,生成的二氧化硫在标准状况下的体积为________ L。
8SO2+2Fe2O3,该反应中被氧化的元素是________(填元素符号)。当该反应转移2.75 mol电子时,生成的二氧化硫在标准状况下的体积为________ L。
(2)实验室中用下列装置测定SO2催化氧化为SO3的转化率。(已知SO3的熔点为16.8 ℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响)
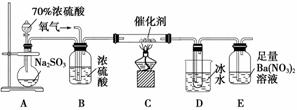
 ①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作:_______________________。
①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作:_______________________。
②实验过程中,需要通入氧气。试写出一个用如右图所示装置制取氧气的化学方程式:____________________________________________。
③当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是____________________________________________________________________。
④实验结束后,若装置D增加的质量为m g,装置E中产生白色沉淀的质量为n g,则此条件下二氧化硫的转化率是________(用含字母的代数式表示,不用化简)。
(3)某学习小组设计用如图装置验证二氧化硫的化学性质。
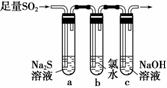
①能说明二氧化硫具有氧化性的实验现象为_________________________________
________________________________________________________________________。
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分成三份,分别进行如下实验。
方案Ⅰ:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液中加入BaCl2溶液,产生白色沉淀
上述方案中合理的是________(填“Ⅰ”、“Ⅱ”或“Ⅲ”);试管b中发生反应的离子方程式为_______________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com