
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源:2014-2015山西省原平市高二上学期期末考试化学试卷(解析版) 题型:选择题
已知反应3A(g)+B(g) C(s)+4D(g)+Q,下图中a、b表示一定条件下,D的体积分数随时间t的变化情况。若要使曲线b变为曲线a,可采取的措施是
C(s)+4D(g)+Q,下图中a、b表示一定条件下,D的体积分数随时间t的变化情况。若要使曲线b变为曲线a,可采取的措施是

①增大B的浓度 ②升高反应温度
③缩小反应容器的体积(加压) ④加入催化剂
A.①② B.①③ C.②③ D.③④
查看答案和解析>>
科目:高中化学 来源:2014-2015黑龙江省鸡西市龙东南七校高一上学期期末联考化学试卷(解析版) 题型:选择题
在无色透明的溶液中,能够大量共存的离子组是
A.Al3+、Ca2+、Cl -、NO3- B.Ba2+、K+、CO32-、Cl -
C.Na+、Cu2+、NO3-、HCO3- D.Na+、Fe2+、Cl -、SO42-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省漳州市八校高三3月联考理综化学试卷(解析版) 题型:选择题
室温下向10 mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是
A.溶液中导电粒子的数目减少
B.醋酸的电离程度增大,c(H+)亦增大
C.溶液中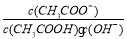 不变
不变
D.再加入10 mL pH=11的NaOH溶液,混合液pH=7
查看答案和解析>>
科目:高中化学 来源:2014-2015黑龙江省高二上学期期末考试化学试卷(解析版) 题型:填空题
(14分)NH3经一系列反应可以得到HNO3和NH4NO3,如下图所示。

(1)Ⅰ中,NH3和O2在催化剂作用下反应,其化学方程式是_______________________。
(2)Ⅱ中,2NO(g)+O2(g)  2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下温度变化的曲线(如图)。
2NO2(g)。在其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下温度变化的曲线(如图)。

①比较p1、p2的大小关系: 。
②随温度升高,该反应平衡常数变化的趋势是 。
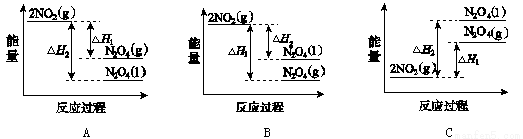
(3)Ⅲ中,降低温度,将NO2(g)转化为N2O4(l),再制备浓硝酸。
①已知:2NO2(g)  N2O4(g) ΔH1 2NO2(g)
N2O4(g) ΔH1 2NO2(g) N2O4(l) ΔH2
N2O4(l) ΔH2
下列能量变化示意图中,正确的是(选填字母) 。
②N2O4与O2、H2O化合的化学方程式是 。
(4)Ⅳ中,电解NO制备NH4NO3,其工作原理如图所示。

为使电解产物全部转化为NH4NO3,需补充A。A是 ,说明理由: 。
查看答案和解析>>
科目:高中化学 来源:2014-2015黑龙江省高二上学期期末考试化学试卷(解析版) 题型:选择题
下列溶液中粒子的物质的量浓度关系正确的是
A.0.1mol/LNaHCO3溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)
B.20mL0.1mol/LCH3COONa溶液与10mL0.1mol/LHCl溶液混合后呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)
C.室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)>c(H+)>c(NH4+)>c(OH-)
D.0.1mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源:2014-2015黑龙江省高二上学期期末考试化学试卷(解析版) 题型:选择题
标准状况下,气态分子断开1mol化学键的焓变称为键焓。已知H—H,H—O和O=O键的键焓△H分别为436kJ/mol,463kJ/mol,495kJ/mol,下列热化学方程式正确的是
A.H2O(g)=H2(g)+1/2O2(g) △H =-485kJ/mol
B.H2O(g)=H2(g)+1/2O2(g) △H =+485kJ/mol
C.2H2(g)+O2(g)=2H2O(g) △H =+485kJ/mol
D.2H2(g)+O2(g)=2H2O(g) △H =-485kJ/mol
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市十三校高三第二次联考化学试卷(解析版) 题型:实验题
(本题共12分)工业烧碱成分NaOH、Na2CO3和可溶于水但不与酸反应的杂质,工业纯碱成分Na2CO3、NaHCO3和可溶于水但不与酸碱反应的杂质。为测定碱中各成分的百分含量可采用滴定法、气体法等。
完成下列填空:
(1)滴定法测定工业烧碱样品:配制250mL待测液,所用的主要仪器有烧杯、量筒、胶头滴管、玻璃棒、 。
(2)测定工业烧碱的总碱量n Na2O(或总耗酸量):进行滴定时,先向盛待测液的锥形瓶中加 作为指示剂。
判断滴定终点的现象是 。
(3)气体法测定工业烧碱的Na2CO3含量(如图):
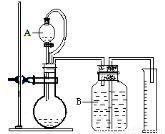
装置中B部分盛放的试液是 。
装置中A部分的分液漏斗与烧瓶之间连接的导管所起的作用是 。
(4)用中和滴定的氯化钡法测定工业烧碱中NaOH的含量时,可先在混合液中滴加过量的BaCl2溶液,再以酚酞作指示剂,然后用标准盐酸滴定。
滴加过量的BaCl2溶液目的是 。
向混有碳酸钡沉淀的氢氧化钠溶液中滴入盐酸,为什么不会使碳酸钡溶解而能测定氢氧化钠的含量 。
(5)用中和滴定的氯化钡法测定工业纯碱中NaHCO3的含量时,使用与测定烧碱相同的实验操作,过程稍作改变即可。
简述该操作过程 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年北京市顺义区高三第一次统一练习化学试卷(解析版) 题型:选择题
下列说法正确的是
A.CO2的电子式:
B.Cl原子的结构示意图:
C.质子数为53,中子数为78的碘原子的核素符号: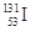
D.2,3-二甲基-2-丁烯的结构简式: 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com