
 科学探究结果的准确性来自于探究活动中研究方法的科学性,研究过程的计划性、研究目的明确性.某学生用如图所示方法研究物质的性质,其中,气体A的主要成分是氯气(含有空气和水蒸气).请回答下列问题:
科学探究结果的准确性来自于探究活动中研究方法的科学性,研究过程的计划性、研究目的明确性.某学生用如图所示方法研究物质的性质,其中,气体A的主要成分是氯气(含有空气和水蒸气).请回答下列问题:

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 实验编号 | 温度(℃) | 催化剂 用量(g) | 酸性高锰酸钾 | |
| 体积 (mL) | 浓度 (mol?L-1) | |||
| 1 | 25 | 0.5 | 4.00 | 0.1000 |
| 2 | 50 | 0.5 | 4.00 | 0.1000 |
| 3 | 25 | 0.5 | 4.00 | 0.0100 |
| 4 | 25 | 0 | 4.00 | 0.1000 |
| 实验编号 | 溶液褪色所需时间(min) | ||
| 第1次 | 第2次 | 第3次 | |
| 1 | 14.0 | 13.0 | 11.0 |
| 3 | 6.5 | 6.7 | 6.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-1 452 kJ?mol-1 |
| B、CH3OH(l)+1.5O2(g)=CO2(g)+2H2O(g)△H=-725.8 kJ?mol-1 |
| C、2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=-725.8 kJ?mol-1 |
| D、2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l)△H=+1 452 kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、V1>V2>V3 |
| B、V1>V3>V2 |
| C、V2>V3>V1 |
| D、V3>V1>V2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 且a、b、c、d均大于零,则下列说法正确的是( )
且a、b、c、d均大于零,则下列说法正确的是( )| A、断开1molH-Cl键所需的能量为-a-b-c |
| B、b>c,则氢气分子具有的能量高于氯气分子具有的能量 |
| C、Cl2(s)=Cl2(g)△H=+(a+d)kJ?mol-1 |
| D、向1molCl2(g)中通入1molH2(g),发生反应时放热dkJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
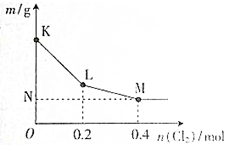 向100mlNaBr和NaI的混合溶液中慢慢通入Cl2(假设Cl2全部反应),使其充分反应后,将所得溶液蒸干、灼烧、得到的固体的质量为m,m与通入的n(Cl2)的关系如图所示,下列说法正确的是( )
向100mlNaBr和NaI的混合溶液中慢慢通入Cl2(假设Cl2全部反应),使其充分反应后,将所得溶液蒸干、灼烧、得到的固体的质量为m,m与通入的n(Cl2)的关系如图所示,下列说法正确的是( )| A、K→L段发生反应的离子方程式为2Br-+Cl2═2Cl-+Br2 |
| B、原溶液中,c(Na+ )=4mol?L-1 |
| C、原溶液中,c(I-)=2mol?L-1 |
| D、M点代表的固体质量为46.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 开始沉淀的pH | 完全沉淀的pH | |
| Fe(OH)2 | 7.0 | 9.0 |
| Fe(OH)3 | 1.9 | 3.2 |
| Cr(OH)3 | 6.0 | 8.0 |
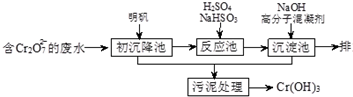
查看答案和解析>>
科目:高中化学 来源: 题型:
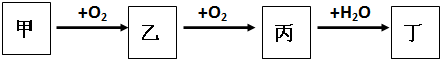
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com