(2013?惠州一模)利用海水资源进行化工生产的部分工艺流程如下图所示:
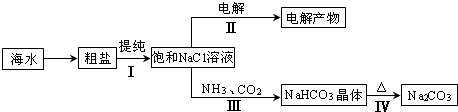
(1)流程Ⅰ中,欲除去粗盐中含有的Ca
2+、Mg
2+、SO
42-等离子,需将粗盐溶解后,按序加入药品进行沉淀、过滤.其加入药品顺序合理的是
bd
bd
.
a.Na
2CO
3、NaOH、BaCl
2溶液 b.NaOH、BaCl
2、Na
2CO
3溶液
c.NaOH、Na
2CO
3、BaCl
2溶液 d.BaCl
2、Na
2CO
3、NaOH溶液
(2)流程Ⅱ中,电解饱和NaCl溶液的离子方程式为
.从原子结构角度分析阴极之所以得到H
2其根本原因是
阳离子为Na+和H+,H+的半径比Na+的半径小,得电子的能力强
阳离子为Na+和H+,H+的半径比Na+的半径小,得电子的能力强
.
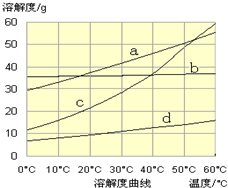
(3)流程Ⅲ中,通过化学反应得到NaHCO
3晶体.下图为NaCl、NH
4Cl、NaHCO
3、NH
4HCO
3的溶解度曲线,其中能表示NaHCO
3溶解度曲线的是
d
d
,化学反应方程式是
NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl
NaCl+CO2+NH3+H2O=NaHCO3↓+NH4Cl
.
(4)流程Ⅳ中,所得纯碱常含有少量可溶性杂质,提纯它的过程如下:
①将碳酸钠样品加适量水溶解、
蒸发浓缩
蒸发浓缩
、
冷却结晶
冷却结晶
、过滤、洗涤2-3次,得到纯净Na
2CO
3?10H
2O.
②对Na
2CO
3?10H
2O脱水得到无水碳酸钠.
已知:Na
2CO
3?H
2O(s)=Na
2CO
3(s)+H
2O(g)△H
1=+58.73kJ?mol
-1 Na
2CO
3?10H
2O(s)=Na
2CO
3?H
2O(s)+9H
2O(g)△H
1=+473.63kJ?mol
-1如把该过程中产生的气态水液化,将释放的热量反补给该生产过程所需的能耗,若不考虑能量无效损失,则理论上生产1molNa
2CO
3只需耗能92.36kJ,由此得出:H
2O(g)=H
2O(l)△H=
-44.00KJ/mol
-44.00KJ/mol
.





 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案