
甲烷分子(CH4)失去一个H+,形成甲基阴离子(CH3-),在这个过程中,下列描述不合理的是( )
| A.碳原子的杂化类型发生了改变 |
| B.微粒的形状发生了改变 |
| C.微粒的稳定性发生了改变 |
| D.微粒中的键角发生了改变 |
 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:单选题
下列对一些实验事实的理论解释正确的是
| 选项 | 实验事实 | 理论解释 |
| A | 氮原子的第一电离能大于氧原子 | 氮原子2p能级半充满 |
| B | CO2为直线形分子 | CO2分子中C—O是极性键 |
| C | 金刚石的熔点低于石墨 | 金刚石是分子晶体,石墨是原子晶体 |
| D | HF的沸点高于HCl | HF的相对分子质量小于HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为 ( )
| A.两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化。 |
| B.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强。 |
| C.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道。 |
| D.氨气分子是极性分子而甲烷是非极性分子。 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
美国科学家合成了含有N5+的盐类,含有该离子的盐是高能爆炸物质,该离子的结构呈“V”形,如图所示。以下有关该物质的说法中正确的是( )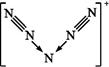
| A.每个N5+中含有35个质子和36个电子 |
| B.该离子中有非极性键和配位键 |
| C.该离子中含有2个π键 |
| D.与PCl4+互为等电子体 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知:
下列说法不正确的是
| A.①和②变化过程中都会放出热量 |
| B.氯原子吸引电子的能力强于钠原子和氢原子 |
| C.①和②中的氯原子均得到1个电子达到8电子稳定结构 |
| D.NaCl中含有离子键,HCl中含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
据新浪科技网报道:美国科学家发现,普通盐水在无线电波的照射下可以燃烧,这很可
能是21世纪人类最伟大的发现之一,将有望解决未来人类的能源危机。无线电频率可以降低盐水中所含元素之间的结合力,释放出氢原子,一旦点火,氢原子就会在这种频率下持续燃烧。上述“结合力”的实质是( )
| A.离子键 | B.共价键 | C.一种静电引力 | D.一种静电斥力 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列物质按只含离子键、只含共价键、既含离子键又含共价键的顺序排列的是( )
| A.氯气 二氧化碳 氢氧化钠 |
| B.氯化钠 过氧化氢 氯化铵 |
| C.氯化钠 过氧化钠 氯化铵 |
| D.氯化钠 氦气 氢氧化钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是( )
| A.有些物质是由原子直接构成,如水晶、金刚砂等;有些物质是由分子直接构成,如干冰、明矾等;有些物质是由离子直接构成的,如皓矾、芒硝等 |
| B.BF3、H2O、SiCl4、PCl5四种分子中所有原子都满足最外层8电子结构 |
| C.非金属氧化物不都是酸性氧化物;金属氧化物不都是碱性氧化物 |
| D.尿素的熔点比醋酸的熔点高,这是由于前者比后者有更大的范德华力所致 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com