
【题目】下列关于物质的分离提纯不正确的是( )
A. 用如图1所示装置分离CCl4和水
B. 除去苯中的少量苯酚,加入适量浓溴水,过滤
C. 实验室用如图2所示装置除去Cl2中的少量HCl
D. 除去O2中混有的少量SO2,可将混合气体依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶
科目:高中化学 来源: 题型:
【题目】H2S 在金属离子的鉴定分析、煤化工等领域都有重要应用。请回答:
(一)H2S 是煤化工原料气脱硫过程的重要中间体。反应原理为
①COS(g)+H2(g)![]() H2S(g)+CO(g) △H=+7kJ/mol
H2S(g)+CO(g) △H=+7kJ/mol
②CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-42kJ/mol
CO2(g)+H2(g) △H=-42kJ/mol
已知断裂 1mol 气态分子中的化学键所需能量如下表所示。
分子 | COS(g) | H2(g) | CO(g) | H2S(g) | H2O(g) | CO2(g) |
能量/kJ/mol | 1310 | 442 | x | 678 | 930 | 1606 |
(1)计算表中 x=____________。
(2)向VL容积不变的密闭容器中充入1molCOS(g)、amolH2(g)和1molH2O(g),发生上述两个反应,其他条件不变时,容器内CO的平衡体积分数与温度(T)的关系如下图所示。

已知:TIK时测得平衡体系中COS为0.80mol,H2为0.85mol。
① 随着温度的升高,CO的平衡体积分数增大,理由是____________。
② a=______。T1K时CO的平衡转化率为_______
③ T1K 时容器内总压强为pMPa,用气体分压代替气体浓度计算反应l 压强平衡常数Kp=____气体组分的分压=总压强×(气体组分的物质的量/气体总物质的量)(结果保留2位小数)。
(3)少量的羰基硫(COS)用氢氧化钠溶液处理的过程如下(部分产物已略去):
![]()
下图是反应Ⅱ中,在不同温度下,反应时间与H2产量的关系图(Na2S的初始含量为3mol),

① Na2S溶液显_______(“酸性”或“碱性”)。
② 判断Tl、T2、T3的大小:_______。
(二)H2S 用于金属离子的鉴定。
(4)已知:25℃时,K(sp)(SnS)= 1.0×10-25, K(sp)(CdS)= 8.0×10-27。该温度下,向浓度均为0.1mol/L的CdCl2和SnCl2的混合溶液中通入H2S,当Sn2+开始沉淀时,溶液中c(Cd2+)=______(溶液体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质及对应用途的说法正确的是( )
A. 利用浓硫酸的脱水性,干燥氢气
B. 氧化镁熔点高,可用于制造耐火材料
C. 碳酸钠溶液呈碱性,可用于治疗胃酸过多
D. 二氧化硅不与任何酸反应,可用石英制造耐酸容器
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里需要纯净的氯化钠溶液,但手边只有混有硫酸钠、碳酸氢铵的氯化钠。某学生设计了如下方案。已知:NH4HCO3![]() NH3↑+CO2↑+H2O
NH3↑+CO2↑+H2O

如果此方案正确,那么:
(1)操作①可选择_________仪器。A、烧瓶B、烧杯C、锥形瓶D、坩埚E、蒸发皿
(2)操作②是否可改为加硝酸钡溶液?为什么?________(填能或不能)理由_________________。
(3)操作③的目的是_________________________________;为什么不先过滤后加碳酸钠溶液?理由是___________________。
(4)加入盐酸的目的_______________(用化学方程式表示)。
(5)操作④的目的是______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝(熔点660℃)是一种应用广泛的金属,工业上用A12O3(熔点2045℃)和冰晶石(Na2AlF6,六氟合铝酸钠)混合熔融后电解制得。回答下列问题:
(l)铝属于活泼金属却能在空气中稳定存在,原因是(用化学用语及相关文字说明)_______.
(2)将0.1 mol/L AlCl3溶液和10%NH4F溶液混合制取Na2AlF6。该实验所用试管及盛装NaF 溶液的试剂瓶均为塑料材质,原因是____________。
(3)下列关于氧化铝的叙述正确的是_______
A.氧化铝可以治疗胃酸过多。
B.氧化铝因为熔点高,可以作耐火材料.
C.氧化铝是铝热剂的成分之一。
D.氧化铝是两性氧化物,所以既能溶于盐酸又能溶于氨水。
(4)某工厂排放出有毒物质NOCl , 它遇水就会生成NO3-。NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为_________。水源中的NO3-对人类健康会产生危害。为了降低水源中NO3-的浓度,有研究人员建议在碱性条件下用铝粉将NO3-还原为N2,该反应的离子方程式为_________,此方法的缺点是处理后的水中生成了A1O3-,仍然可能对人类健康产生危害,还需要对该饮用水进行一系列后续处理。
已知25℃时,Ksp[Al(OH)3] = l.3×l0-33 Al(OH)3![]() AlO2-+H++H2O K=1.0×10-13
AlO2-+H++H2O K=1.0×10-13
25℃时,若欲使上述处理后的水中A1O2-浓度降到1.0×10-6mol/L,则应调节至pH=_______。
此时水中c(A13+)=__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中含有各种盐类,其中70%为氯化钠,另外还含有氯化镁、硫酸镁等。某化学兴趣小组为了从海水中分离出氯化钠,设计了如下实验方案:
海水 滤液
滤液 滤液
滤液 NaCl溶液
NaCl溶液![]() NaCl
NaCl
(1)步骤Ⅰ中试剂A为________,加入过量A的目的是________。
(2)步骤Ⅱ中试剂B为________,加入过量B的目的是________。
(3)步骤Ⅲ中试剂C为_____,加入过量C至______,其目的是________。
(4)步骤Ⅳ的实验操作为________,试根据图示回答:

①按顺序写出图中编号仪器的名称:_________________________;
②仪器a的作用是________,其目的是_________________________。
③当仪器b中出现________时即可停止加热。
(5)该化学兴趣小组用分离得到的氯化钠配制100 mL 1 mol/L的NaCl溶液,配制过程中需用托盘天平称取精盐的质量为______g,用于定容的玻璃仪器的规格和名称是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z在周期表中的位置关系如图所示,下列说法不正确的是

A. 若它们均为金属元素,则Y的氧化物可能含有共价键
B. 若Z的核电荷数是X的2倍,则ZX2为大气污染物
C. 若Y的最外层电子数等于其周期序数,则Z可为半导体材料
D. 若X、Z均为非金属元素,则形成酸的酸性X一定强于Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸丁酯是重要的化工原料,具有水果香味。实验室制备乙酸丁酯的反应、装置示意图和有关信息如下:
CH3COOH+CH3CH2CH2CH2OH![]() CH3COOCH2CH2CH2CH3+H2O
CH3COOCH2CH2CH2CH3+H2O
物质 | 乙酸 | 正丁醇 | 乙酸丁酯 |
熔点/ ℃ | 16.6 | -89.5 | -73.5 |
沸点/ ℃ | 117.9 | 117 | 126.0 |
密度/g·cm-3 | 1.1 | 0.80 | 0.88 |
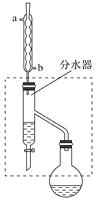
(1)乙酸丁酯粗产品的制备
在干燥的50 mL圆底烧瓶中,装入沸石,加入12.0 mL正丁醇和16.0 mL冰醋酸(过量),再加3~4滴浓硫酸。然后再安装分水器(作用:实验过程中不断分离除去反应生成的水)、冷凝管,然后小火加热。将烧瓶中反应后的混合物冷却与分水器的酯层合并。装置中冷水应从________(填“a”或“b”)管口通入;通过分水器下端旋塞分出的生成物是________,其目的是_____________________________。
(2)乙酸丁酯的精制
将乙酸丁酯粗产品用如下的操作进行精制:①水洗、②蒸馏、③用无水MgSO4干燥、④用10%碳酸钠洗涤。
①正确的操作步骤是________(填标号)。
A.①②③④ B.③①④②
C.①④①③② D.④①③②③
②分液漏斗有两种,如下图。分液时应选择下图中________形分液漏斗,其原因是_____________________________________________。

③蒸馏操作时,需收集________ ℃的馏分,沸点大于140 ℃的有机化合物的蒸馏,一般不用上述冷凝管而用空气冷凝管,可能原因是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pOH=-lgc(OH-),在常温下溶液中的pH+pOH=14,又已知正常人(人的体温高于室温)的血液pH=7.3,则正常人血液的pOH是( )
A. 大于6.7 B. 小于6.7
C. 等于6.7 D. 无法判断
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com