
根据原子结构及元素周期律的知识,下列推断正确的是( )
A.同主族元素含氧酸的酸性随核电荷数的增加而减弱
B.核外电子排布相同的微粒化学性质也相同
C.Cl-、S2-、Ca2+、K+半径逐渐减小
D. 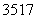 Cl与
Cl与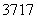 Cl得电子能力相同
Cl得电子能力相同
科目:高中化学 来源: 题型:
0.2 mol有机物和0.4 mol O2在密闭容器中燃烧后产物为CO2、CO和H2O(g)。产物经过浓H2SO4后,质量增加10.8 g;再通过灼热的CuO,充分反应后,CuO质量减轻3.2 g,最后气体再通过碱石灰被完全吸收,质量增加17.6 g。(提示:同一个C原子连两个羟基是不稳定结构)通过计算解决以下两个问题,要有必要计算过程:
(1)试推断该有机物的分子式。
(2)若0.2 mol该有机物恰好能与9.2 g金属钠完全反应,试确定该有机物的结构简式。
查看答案和解析>>
科目:高中化学 来源: 题型:
⑴请选择合适方法的字母代号填空:
①从海水中提取粗盐________; ② 煤转化为焦炭、煤焦油等________;
③ 工业上由氧化铝制取金属铝________; ④ 提纯氢氧化铁胶体________。
A.过滤 B.裂解 C.分馏 D.裂化 E.干馏 F.还原
 G.电解 H.溶解 I.渗析 J.蒸发 K.氧化
G.电解 H.溶解 I.渗析 J.蒸发 K.氧化
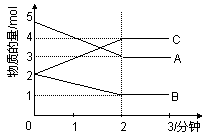
⑵某可逆反应从0—2分钟进行过程中, 在不同反应时间各物质的量的变化情况如右图所示。则该反应的的反应物是 ,生成物是 ,此反应 (填是或不是)可逆反应;反应开始至2分钟时, _____ (能或不能)用C表示反应速率,2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了 ____ 状态,此时正反应速率 逆反应速率(填等于或不等于)。
查看答案和解析>>
科目:高中化学 来源: 题型:
目前上海大部分城市居民所使用的燃料主要是管道煤气,浦东新区居民开始使用东海天然气作为民用燃料。管道煤气的主要成分是CO、H2和少量烃类,天然气的主要成分是CH4。它们的燃烧反应如下:
2CO+O2 2CO2
2CO2
2H2+O2 2H2O
2H2O
CH4+2O2 CO2+2H2O
CO2+2H2O
(1)根据以上化学方程式判断:燃烧相同体积的管道煤气和天然气,消耗空气体积较大的是__________。因此燃烧管道煤气的灶具如需改烧天然气,灶具的改进方法是__________进风口(填“增大”或“减小”),如不做改进可能产生的不良结果是_________________。
(2)管道煤气中含有的烃类除甲烷外,还有少量乙烷、丙烷、丁烷等,它们的某些性质见下表:
| 乙烷 | 丙烷 | 丁烷 | |
| 熔点/℃ | -183.3 | -189.7 | -138.4 |
| 沸点/℃ | -88.6 | -42.1 | -0.5 |
试根据以上某个关键数据解释冬天严寒的季节有时管道煤气火焰很小,并且呈断续状态的原因是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究小组为了探究一种无机矿物盐X(仅含四种元素)的组成和性质,设计并完成了如下实验:

另取10.80 g X在惰性气流中加热至完全分解,得到6.40 g固体1。请回答如下问题:
(1)画出白色沉淀1中金属元素的原子结构示意图:________________。写出气体甲的电子式:________。
(2)X的化学式是________,在惰性气流中加热X至完全分解的化学方程式为__________________________________________________________。
(3)白色沉淀2在空气中变成红褐色沉淀的原因是______________________________(用化学反应方程式表示)。
(4)一定条件下,气体甲与固体1中的某种成分可能发生氧化还原反应,写出一个可能的化学反应方程式:_____________________________________________________,并设计实验方案验证该反应的产物:__________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等。回答下列问题:
(1)铅是碳的同族元素,比碳多4个电子层。铅在元素周期表的位置为第________周期、第________族;PbO2的酸性比CO2的酸性________(填“强”或“弱”)。
(2)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为_______________________。
(3)PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为___________________;PbO2也可以通过石墨为电极,Pb(NO3)2和Cu(NO3)2的混合溶液为电解液电解制取。阳极发生的电极反应式为____________________,阴极上观察到的现象是____________________;若电解液中不加入Cu(NO3)2,阴极发生的电极反应式为______________________________,这样做的主要缺点是____________________。
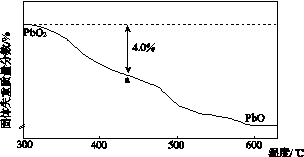
(4)PbO2在加热过程发生分解的失重曲线如下图所示,已知失重曲线上的a点为样品失重4.0%(即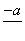 ×100%)的残留固体。若a点固体组成表示为PbOx或mPbO2·nPbO,列式计算x值和m∶n值_______________________________________
×100%)的残留固体。若a点固体组成表示为PbOx或mPbO2·nPbO,列式计算x值和m∶n值_______________________________________
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
月球含有H、He、N、Na、Mg、Si等元素,是人类未来的资源宝库。
(1)3He是高效核能原料,其原子核内中子数为________。
(2)Na的原子结构示意图为________,Na在氧气中完全燃烧所得产物的电子式为________。
(3)MgCl在工业上应用广泛,可由MgO制备。
①MgO的熔点比BaO的熔点________(填“高”或“低”)。
②月球上某矿石经处理得到的MgO中含有少量SiO2,除去SiO2的离子方程式为__________________________;SiO2的晶体类型为________。
③MgO与炭粉和氯气在一定条件下反应可制备MgCl2。若尾气可用足量NaOH溶液完全吸收,则生成的盐为________________(写化学式)。
(4)月壤中含有丰富的3He,从月壤中提炼1 kg 3He,同时可得6000 kg H2和700 kg N2,若以所得H2和N2为原料经一系列反应最多可生产碳酸氢铵________kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
由海水制备无水氯化镁,主要有以下步骤:①在一定条件下脱水干燥;②加熟石灰;③加盐酸;④过滤;⑤浓缩结晶。其先后顺序正确的是
A.②④③⑤① B.③②④①⑤ C.③④②⑤① D. ②④⑤③①
查看答案和解析>>
科目:高中化学 来源: 题型:
将一定质量的铜粉加入到100mL,某浓度的稀硝酸中充分反应后,容器中剩有m1g铜粉,此时共收集到NO气体448mL(标准状况) 。然后向上述混合物中加入稀硫酸至不再反应为止容器剩有铜粉m2g,则m1-m2为( ) A.5.76 B.2.88 C.1.44 D.4.32
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com