
设NA为阿伏加德罗常数的值,下列叙述正确的是()
A. 60g SiO2中含有NA个SiO2分子
B. 标准状况下,2.24L NH3和CH4的混合气体,所含电子总数为2NA
C. 1mol CO2与含1mol NaOH的溶液反应后,溶液中HCO3﹣数为NA
D. 1mol C5H12分子中共价键总数为16NA
考点: 阿伏加德罗常数.
专题: 阿伏加德罗常数和阿伏加德罗定律.
分析: A.二氧化硅为原子晶体,不存在二氧化硅分子;
B.氨气和甲烷分子中都含有10个电子,标况下2.24L甲烷和氨气的混合物的物质的量为0.1mol,含有1mol电子;
C.碳酸氢钠溶液中,碳酸氢根离子部分水解,导致碳酸氢根离子数目减少;
D.戊烷分子中含有4个碳碳键、12个碳氢键,总共含有16个共价键.
解答: 解:A.二氧化硅固体为原子晶体,其晶体中不存在二氧化硅分子,故A错误;
B.标准状况下,2.24L NH3和CH4的物质的量为0.1mol,0.1mol该混合气体中含有1mol电子,所含电子总数为NA,故B错误;
C.1mol CO2与含1mol NaOH的溶液反应生成1mol碳酸氢钠,由于碳酸氢根离子部分水解,则溶液中HCO3﹣数小于NA,故C错误;
D.1mol戊烷中含有4mol碳碳共价键、12mol碳氢共价键,总共含有16mol共价键,共价键总数为16NA,故D正确;
故选D.
点评: 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确离子晶体、原子结构中不含分子,要求学生掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:
根据维生素C的性质,想想,平时炒菜时应怎样做才能保存维生素?( )
|
| A. | 洗菜要先洗后切 | B. | 切菜要随切随炒 |
|
| C. | 烹调蔬菜时适当加点醋 | D. | 炒菜一定要快 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列水解的离子方程式正确的是()
A. HS﹣+H2O⇌S2++H2O+ B. Fe3++3H2O⇌Fe(OH)3↓+3H+
C. CO32﹣+2H2O⇌H2CO3+2OH﹣ D. NH4++H2O⇌NH3•H2O+H+
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)含酚酞的Na2CO3溶液溶液显红色的原因为(用离子方程式解释).
(2)Na2S溶液中离子浓度由大到小的顺序为 ,向该溶液中加入少量固体CuSO4,溶液pH_(填“增大”、“减小”或“不变”).
(3)配制FeSO4溶液要加入
(4)明矾可作净水剂,原理为(用离子方程式解释)
查看答案和解析>>
科目:高中化学 来源: 题型:
某配位化合物的水溶液为深蓝色,由原子序数依次增大的A、B、C、D、E五种元素组成,其原子个数比为l4:4:5:1:1.其中C、D元素同主族且原子序数D为C的二倍,E元素的外围电子排布为(n﹣1)d n+6nsl,回答下列问题.
(1)元素D在周期表中的位置是 .
(2)该配位化合物的化学式为 .
(3)C元素可与A元素形成两种常见的化合物,其原子个数比分别为1:1和l:2,两种化合物可任意比互溶,解释其主要原因为 .
(4)A元素与B元素可形成分子式为A2B2的某化合物,该化合物的分子具有平面结构,则其结构式为 .
(5)已知E的晶胞结构如下图所示,则E的配位数 ;EDC4常作电镀液,其中DC42﹣的空间构型是 ,其中D原子的杂化轨道类型是 .
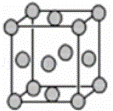
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿伏加德罗常数,下列说法正确的是 ( )
A.2.7 g铝与足量的NaOH溶液反应,转移的电子总数为NA
B.1 mol Al分别放入足量的冷的浓HNO3、稀HNO3中,反应后转移的电子均为3NA个
C.各5.6 g铁分别与足量的盐酸、氯气反应,电子转移总数均为0.3NA
D.1 mol Na与足量O2反应生成Na2O或Na2O2均失去NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作中,一般情况下不应该相互接触的是()
A. 用胶头滴管向试管中滴液体时,滴管尖端与试管内壁
B. 向容量瓶中转移液体时,使用的玻璃棒与容量瓶颈内壁
C. 用滴定管向锥形瓶内注入一定体积的待测溶液时,滴定管的尖嘴与锥形瓶内壁
D. 实验室将HCl气体溶于水时,漏斗口与水面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com