
| A、准确称取0.4000g NaOH固体可配成100mL 0.1000mol?L-1的NaOH标准溶液 |
| B、已知Ksp[Fe(OH)3]=4.0×10-38,则Fe3++3H2O?Fe(OH)3+3H+的平衡常数K=2.5×10-5 |
| C、100mL pH=3的HA和HB分别与足量的锌反应,HB放出的氢气多,说明HB酸性比HA弱 |
| D、对于反应2SO2(g)+O2(g)?2SO3(g),压缩气体体积使压强增大(其他条件不变),则SO2的转化率增大,平衡常数K也增大 |
| 10-14 |
| c(OH-) |
| [H+]3 |
| [Fe3+] |
| 10-42 |
| c(Fe3+)×c(OH-)3 |


科目:高中化学 来源: 题型:
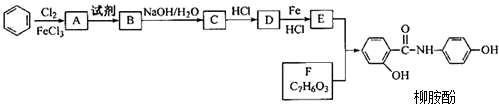
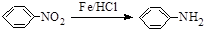 .请回答下列问题:
.请回答下列问题: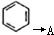 的化学方程式
的化学方程式查看答案和解析>>
科目:高中化学 来源: 题型:

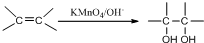
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 室温时,向20mL 0.1mol?L-1的醋酸溶液中不断滴入0.1mol?L-1的NaOH溶液,溶液的pH变化曲线,如图所示.在滴定过程中,关于溶液中离子浓度大小关系的描述不正确的是( )
室温时,向20mL 0.1mol?L-1的醋酸溶液中不断滴入0.1mol?L-1的NaOH溶液,溶液的pH变化曲线,如图所示.在滴定过程中,关于溶液中离子浓度大小关系的描述不正确的是( )| A、a点时:c ( CH3COOH )>c ( Na+)>c ( CH3COO-)>c ( H+)>c ( OH -) |
| B、b点时:c ( Na+)=c ( CH3COO-)>c ( H+)=c ( OH-) |
| C、c点时:c ( OH-)=c ( CH3COOH )+c ( H+) |
| D、d点时:c ( Na+)>c ( CH3COO-)>c (OH-)>c ( H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 酸 | HClO4 | H2SO4 | HCl | HNO3 |
| Ka | 1.6×10-5 | 6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
| A、在冰醋酸中这四种酸都没有完全电离 |
| B、在冰醋酸中高氯酸是这四种酸中最强的酸 |
| C、在冰醋酸中硫酸的电离方程式为 H2SO4=2H++SO42- |
| D、水对于这四种酸的强弱没有区分能力,但醋酸可以区分这四种酸的强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、相同物质的量浓度的醋酸和盐酸中和氢氧化钠的量一定相同. |
| B、PH=4的Al2(SO4)3溶液中,水电离出H+的物质的量浓度为10-10 mol.L-1 |
| C、相同浓度的下列溶液:①CH3COONH4 ②CH3COONa ③CH3COOH中,c(CH3COO)由大到小的顺序是②>①>③ |
| D、0.1mol.L-1 NaHCO3溶液中c(Na+)=c(HCO3-)+2c(CO32-)+c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 第一电离能 | 离子半径 | 沸点 |
| Na | O2- | CH4 |
| 物 质 | CH4 | CO2 | CO | H2 |
| 体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
| ||
| 电解 |

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com