
分析 依据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$=$\frac{V}{Vm}$计算,结合1个氨气分子含有10个电子,3个氢原子的结构特点解答.
解答 解:标准状况下,11.2L NH3中物质的量为:$\frac{11.2L}{22.4L/mol}$=0.5mol,质量m=0.5mol×17g/mol=8.5g;含有电子的物质的量为0.5mol×10=5mol;含有氢原子物质的量为:0.5mol×3=1.5mol;个数为1.5mol×NA=1.5NA;
故答案为:0.5;8.5;5;1.5NA;1.5.
点评 本题考查了有关物质的量计算,熟悉以物质的量为核心的计算公式,明确氨气的组成和结构是解题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
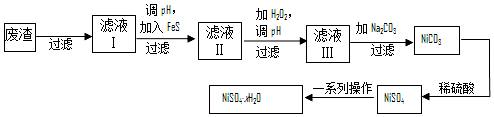
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
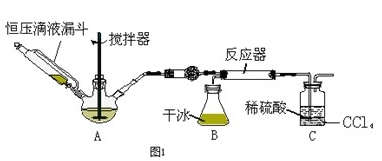
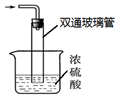
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Ag+、NO3-、Cl- | B. | NH4+、Ba2+、Cl-、CO32- | ||
| C. | H+、Ca2+、CO32-、NO3- | D. | Na+、Al3+、SO42-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发溶剂 | B. | 升高温度 | C. | 降低温度 | D. | 加入KN03固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(CH3COOH):①>② | B. | c(CH3COO-):①>② | ||
| C. | c(CH3COOH)+c(CH3COO-):①=② | D. | c(CH3COO-)+c(OH-):①<② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
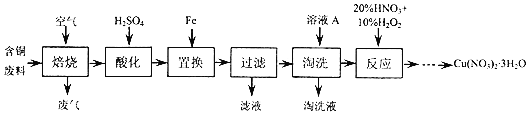

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com