
| 实验步骤 | 实验结论 |
| ①氯水+1mLCCl4,振荡、静置, 观察四氯化碳层颜色 |
氧化性从强到弱的 顺序: Cl2>Br2>I2 |
| ②NaBr溶液+氯水+1mLCCl4, 振荡、静置,观察四氯化碳层颜色 | |
| ③KI溶液+氯水+1mLCCl4, 振荡、静置,观察四氯化碳层颜色 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:阅读理解
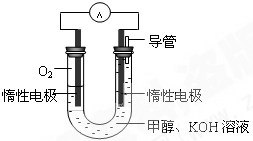 甲醇是重要的化工原料,在日常生活中有着广泛的应用.
甲醇是重要的化工原料,在日常生活中有着广泛的应用. CH3OH(g)△H1
CH3OH(g)△H1 CH3OH(g)+H2O(g)△H2
CH3OH(g)+H2O(g)△H2| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:
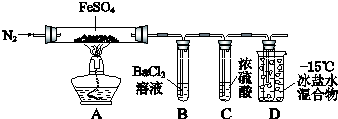
| 实验过程 | 实验现象 | |
| ① | 通入一段时间N2,加热 | A中固体变为红棕色,B中有白色沉淀,D试管中有无色液体 |
| ② | 用带有火星的木条靠近装置D的导管口 | 木条复燃 |
| ③ | 充分反应,停止加热,冷却后,取A中固体,加盐酸 | 固体溶解,溶液呈黄色 |
| ④ | 将③所得溶液滴入D试管中 | 溶液变为浅绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
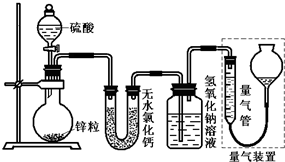 不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气.为了验证这一事实,某同学拟用如图装置进行实验(实验时压强为10l kPa,温度为0℃).
不同浓度的硫酸与锌反应时,硫酸可以被还原为SO2,也可被还原为氢气.为了验证这一事实,某同学拟用如图装置进行实验(实验时压强为10l kPa,温度为0℃).查看答案和解析>>
科目:高中化学 来源:2013届北京市西城区高三上学期期末考试化学试卷(带解析) 题型:实验题
(8分)某小组取一定质量的FeSO4固体,利用下图装置进行实验。
| | 实验过程 | 实验现象 |
| ① | 通入一段时间N2,加热 | A中固体变为红棕色,B中有白色沉淀,D试管中有无色液体 |
| ② | 用带有火星的木条靠近装置D的导管口 | 木条复燃 |
| ③ | 充分反应,停止加热,冷却后,取A中固体,加盐酸 | 固体溶解,溶液呈黄色 |
| ④ | 将③所得溶液滴入D试管中 | 溶液变为浅绿色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com