
 中国最新战机歼-31使用了高强度、耐高温的钛合金材料.工业上冶炼钛的反应如下:TiCl4+2Mg=Ti+2MgCl2.下列有关该反应的说法正确的是( )
中国最新战机歼-31使用了高强度、耐高温的钛合金材料.工业上冶炼钛的反应如下:TiCl4+2Mg=Ti+2MgCl2.下列有关该反应的说法正确的是( )| A. | TiCl4是还原剂 | |
| B. | 每消耗1mol Mg,Mg得到2mol电子 | |
| C. | TiCl4发生氧化反应 | |
| D. | 为防止Mg、Ti被氧化该反应可在氩气流中进行 |
分析 TiCl4+2Mg=Ti+2MgCl2反应中Ti元素化合价降低,Mg的化合价升高,结合氧化还原反应的概念分析解答.
解答 解:TiCl4+2Mg=Ti+2MgCl2反应中Ti元素化合价降低,Mg的化合价升高,
A.反应中Ti元素化合价降低,则TiCl4为氧化剂,故A错误;
B.反应中Mg失电子,则每消耗1mol Mg,Mg失去2mol电子,故B错误;
C.反应中Ti元素化合价降低,则TiCl4发生还原反应,故C错误;
D.Mg、Ti元素易被氧气氧化,所以为防止Mg、Ti被氧化该反应可在氩气流中进行,故D正确;
故选D.
点评 本题考查氧化还原反应,明确元素化合价变化是解本题关键,题目难度不大.


 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:选择题

| A. | PAFC因水解而能净水 | |
| B. | 往甲溶液中滴入KSCN溶液后呈血红色 | |
| C. | 试剂X具有氧化性 | |
| D. | 乙溶液呈酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某物质的溶液中由水电离出的c(H+)=1×10-amol/L,若a>7时,则该溶液的pH一定为14-a | |
| B. | 某溶液中存在的离子有S2-、HS-、OH-、Na+、H+,则离子浓度一定是c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+) | |
| C. | pH=3的二元弱酸H2R溶液与 pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液:c(R2-)+c(HR-)=c(Na+) | |
| D. | 将0.2 mol/L的某一元酸HA溶液和0.1mol/L NaOH溶液等体积混合后溶液pH大于7,则反应后的混合液:c(OH-)+c(A-)=c(H+)+c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 在某一容积为5L的密闭容器内,加入0.2mol的CO和0.2mol 的H2O(g),在催化剂存在的条件下高温加热,发生如下反应:CO(g)+H2O(g)═CO2(g)+H2(g),反应放出热量.反应中CO2的浓度随时间变化的情况如图所示:
在某一容积为5L的密闭容器内,加入0.2mol的CO和0.2mol 的H2O(g),在催化剂存在的条件下高温加热,发生如下反应:CO(g)+H2O(g)═CO2(g)+H2(g),反应放出热量.反应中CO2的浓度随时间变化的情况如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
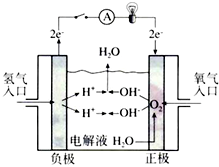 氢氧燃料电池已用于航天飞机.以30%KOH溶液为电解质溶液的这种电池在使用时的电极反应.试写出:
氢氧燃料电池已用于航天飞机.以30%KOH溶液为电解质溶液的这种电池在使用时的电极反应.试写出:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
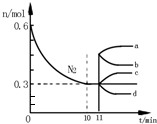 研究氮机器化合物对化工生产有重要意义.
研究氮机器化合物对化工生产有重要意义.| T/℃ | T1 | T2 | T3 |
| K | 10 | 2.5 | 1.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在蔗糖中加入浓硫酸后出现发黑现象,说明浓硫酸具有脱水性 | |
| B. | 浓硝酸在光照下颜色变黄,说明浓硝酸不稳定 | |
| C. | 常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应 | |
| D. | 浓硫酸常温下与铜不反应,加热时才能发生反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com