
【题目】下列关于二氧化氮的性质描述正确的是
A. 无毒B. 无色C. 无味D. 红棕色
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】有机物A的结构简式为 ,下列有关A的说法中正确的是( )
,下列有关A的说法中正确的是( )
A. 常温下,1molA能消耗2molNaOH
B. 1molA与足量的金属钠反应能生成22.4L氢气
C. 1 molA完全燃烧能消耗6molO2
D. A在一定条件下发生酯化反应能生成六元环酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】紫菜中含有比较丰富的碘,通常以KI形式存在。KMnO4是强氧化剂,能氧化H2O2、SO32—、Br—、I—、S2—、Fe2+等。某化学兴趣小组拟对市面上销售的某品牌紫菜进行碘的提取和含碘量测定,设计了如下实验步骤:
A.将灼烧后的紫菜灰溶于水,配成悬浊液,过滤
B.将水溶液和试剂甲加入分液漏斗中,震荡后静置,放出下层溶液备用
C.取干燥的紫菜m g于坩埚中灼烧
D.向滤液中滴加少量硫酸酸化的3%的H2O2溶液a ml,充分反应
E.对下层溶液进行某操作,得到碘单质并回收试剂甲
(1)对上述实验步骤进行合理的排序:__________________________________。
(2)步骤D中发生的离子反应为:____________________________________________。
小组中甲同学分析实验时认为步骤D中的H2O2可能有剩余,故取少量酸性高锰酸钾溶液,向其中滴加D中反应后的溶液,若溶液的紫色褪去,则说明H2O2还剩余。小组乙同学认为该结论存在不严谨的地方,请指出你认为不严谨的地方:__________________________
(3)步骤E中“某操作”是_____________。
(4)若实验用的H2O2溶液的密度为1g/cm3,假定所加H2O2溶液恰好完全反应完,则该紫菜中碘的含量可表示为:_______________g/100g(结果不化简)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列说法中正确的是
A.1mol/L盐酸溶液中含H+ 1 mol
B.常温常压下,1mol CH4的质量为16g/mol
C.28g C2H4和C3H6混合气体原子数目为6NA
D.标准状况下,2.24 L H2O中所含原子数均为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种军用烟幕弹中装有ZnO、Al粉和C2Cl6 , 其发烟过程中的化学反应如下: ①3ZnO+2Al→Al2O3+3Zn ②3Zn+C2Cl6→3ZnCl2+2C
下列有关叙述不正确的是( )
A.反应①是铝热反应
B.反应②是置换反应
C.C2Cl6属于卤代烃
D.氧化性:Al<Zn<C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA代表阿伏加德罗常数,下列叙述正确的是
A. 78 g Na2O2中含有的离子总数为4NA
B. 标准状况下,1.12 L HF中所含的分子总数为0.05 NA
C. 由CO2和O2组成的混合物共有Na个分子,其中的氧原子数为2 NA
D. 0.1 mol L-1 FeCl3溶液中含有的Cl-数目为0.3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.元素周期表中80%左右的非金属元素在现代技术包括能源、功能材料等领城占有极为重要的地位。
(1)氮及其化合物与人类生产、生活息息相关,基态N原子中电子在2p轨道上的排布遵循的原则是_____,N2F2分子中N原子的杂化方式是_______,1mol N2F2含有____个δ键。
(2)高温陶瓷材料Si3N4晶体中N-Si-N的键角大于Si-N-Si的键角,原因是_______。
II.金属元素铁、铜及其化合物在日常生产、生活有着广泛的应用。
(1)铁在元素周期表中的位置_________。
(2)配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于_____(填晶体类型)。Fe(CO)x的中心原子价电子数与配体提供电子吸之和为18,则x=________。
(3)N2是CO的一种等电子体,两者相比较沸点较高的为_______(填化学式)。
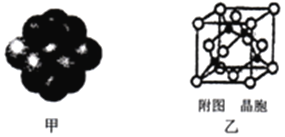
(4)铜晶体中铜原子的堆积方式如下图甲所示。
①基态铜原子的核外电子排布式为___________。
② 每个铜原子周围距离最近的铜原子数目为___________。
(5)某M原子的外围电子排布式为3s23p5,铜与M形成化合物的晶胞如下图乙所示(黑点代表铜原子)。己知该晶体的密度为ρ g·cm-3,阿伏加德罗常数为NA,则该晶体中铜原子和M原子之间的最短距离为_________pm。(只写计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇是一种常用的工业燃料,燃料乙醇的生产过程可由下图表示:
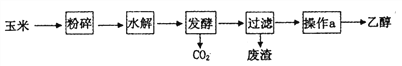
(1)粉碎玉米的目的是____________。
(2)生产过程中检验玉米中是否完全水解的方法是_________。
(3)请写出“发酵”过程中反应的化学方程式_____________;发酵产生的CO2纯度可达到99%,能回收利用,请举出它的两项用途:______________________、________________________
(4)操作a的名称是_________,检验乙醇中是否含有水可以用试剂______。
(5)根据上述生产过程,用5吨含淀粉70%的玉米,假设淀粉水解的百分率为85%,发酵过程的转化率为60%,则最终可以制得无水乙醇________kg(小数点后保留一位有效数字)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com