
下面关于Na2CO3和NaHCO3性质的叙述,不正确的是
A.在水中的溶解度:碳酸钠>碳酸氢钠
B.热稳定性:碳酸钠>碳酸氢钠
C.溶液酸碱性:物质的量浓度相同时,Na2CO3溶液pH小于NaHCO3溶液的pH
D.等质量的碳酸钠和碳酸氢钠分别与足量的盐酸反应,消耗HCl的量前者多
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源:2016届甘肃省张掖市高三上第一次诊断考试理综化学试卷(解析版) 题型:选择题
以酸性氢氧燃料电池为电源进行电解的实验装置如下图。下列叙述正确的是( )
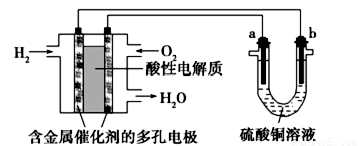
A.燃料电池工作时,正极反应为O2+2H2O+4e-=4OH-
B.a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出
C.a、b两极若是石墨,在相同条件下a极产生的气体与电池中消耗的H2体积相等
D.a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
查看答案和解析>>
科目:高中化学 来源:2016届吉林省高三上第二次模拟化学试卷(解析版) 题型:选择题
一定体积的酸性KMnO4溶液恰好能氧化一定质量的KHC2O4·H2C2O4·2H2O。若用0.2000 mol·L-1的NaOH溶液中和相同质量的KHC2O4·H2C2O4·2H2O,所需NaOH溶液的体积恰好为KMnO4溶液的3倍,则KMnO4溶液的浓度(mol·L-1)为
A.0.0176 B.0.1600 C.0.1200 D.0.2400
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东省高二上学期期中测试化学试卷(解析版) 题型:填空题
甲醇(CH3OH)和二甲醚(CH3OCH3)被称为21世纪的新型燃料,具有清洁、高效等优良的性能。
(1)CO2可用于合成二甲醚(CH3OCH3),有关反应的热化学方程式如下:
CO2(g) + 3H2(g) = CH3OH(g) + H2O(g) ΔH = -49.0kJ·mol-1,
2CH3OH(g) = CH3OCH3(g)+ H2O(g) ΔH =-23.5kJ·mol-1,
则CO2与H2反应合成二甲醚的热化学方程式为 。
(2)若反应2CH3OH(g)  CH3OCH3(g) + H2O(g)在某温度下的化学平衡常数为400,此温度下,在密闭容器中加入一定量甲醇,反应进行到某时刻,测得各物质的浓度如表所示:
CH3OCH3(g) + H2O(g)在某温度下的化学平衡常数为400,此温度下,在密闭容器中加入一定量甲醇,反应进行到某时刻,测得各物质的浓度如表所示:
物质 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
浓度(mol·L-1) | 0.44 | 0.60 | 0.60 |
①写出该反应的平衡常数表达式:K= 。
②比较该时刻正、逆反应速率的大小:v(正) v(逆)(填“>”、“<”或“=”)
③若加入甲醇后经 10 min 反应达到平衡,则平衡后c(CH3OH)= ,该时间内反应速率v(CH3OCH3)= 。
(3)工业上合成甲醇的反应:CO(g)+2H2(g) CH3OH(g) ΔH =-90.8kJ·mol-1,若在温度相同、容积均为2L的3个容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时如下:
CH3OH(g) ΔH =-90.8kJ·mol-1,若在温度相同、容积均为2L的3个容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时如下:
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 1molCO、2 mol H2 | 1 mol CH3OH | 2 mol CO、4 mol H2 |
CH3OH的浓度(mol/L) | c1=0.25 | c2 | c3 |
反应的能量变化 | 放出Q1 kJ | 吸收Q2 kJ | 放出Q3 kJ |
平衡常数 | K1 | K2 | K3 |
反应物转化率 | α1 | α2 | α3 |
①下列不能说明该反应在恒温恒容条件下已达化学平衡状态的是 。
A. v正(H2)= 2v逆(CH3OH) B. n(CO)﹕n(H2)﹕n(CH3OH)=1﹕2 : 1
C. 混合气体的密度不变 D. 混合气体的平均相对分子质量不变
E. 容器的压强不变
②下列说法正确的是 。
A. c1= c2 B. Q1= Q2 C. K1= K2 D. α2+α3 < 100%
③如图表示该反应的反应速率v和时间t的关系图:
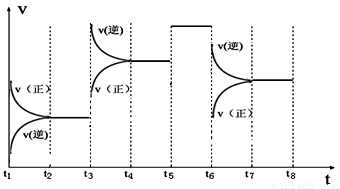
各阶段的平衡常数如下表所示:
t2~t3 | t4~t5 | t5~t6 | t7~t8 |
K4 | K5 | K6 | K7 |
K4、K5、K6、K7之间的关系为 (填“>”、“<”或“=”)。反应物的转化率最大的一段时间是 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省雅安市高二上学期期中测试化学试卷(解析版) 题型:选择题
下列图式表示正确的是
A.二氧化碳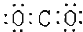
B.次氯酸的结构式 H-Cl-O
C.铝离子的结构示意图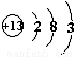
D.基态碳原子的价电子排布图为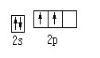
查看答案和解析>>
科目:高中化学 来源:2016届浙江省深化课程改革协作校高三上学期11月期中联考化学试卷(解析版) 题型:选择题
我国科学家最新研发的固体透氧膜提取金属钛工艺,其电解装置如右图所示:将TiO2熔于NaCl-NaF融盐体系,以石墨为阴极,覆盖氧渗透膜的多孔金属陶瓷涂层为阳极,固体透氧膜把阳极和熔融电解质隔开,只有O2-可以通过。下列说法不正确的是

A.a 极是电源的正极,O2-在熔融盐中从右往左迁移
B.阳极电极反应式为2O2--4e- = O2↑
C.阳极每产生4.48L的O2,理论上能生成0.2mol钛
D.NaCl-NaF融盐的作用是降低熔化TiO2需要的温度
查看答案和解析>>
科目:高中化学 来源:2015-2016学年福建省高一上学期期中考试化学试卷(解析版) 题型:选择题
相同条件下,两种气体的体积相同,则两种气体
A.物质的量一定相等
B.密度一定相等
C.质量一定相等
D.所含的原子数一定相等
查看答案和解析>>
科目:高中化学 来源:2016届重庆市高三11月月考理科综合化学试卷(解析版) 题型:选择题
在混合体系中,确认化学反应先后顺序有利于问题的解决,下列反应先后顺序判断正确的是
A.在含等物质的量的FeBr2、FeI2的溶液中缓慢通入Cl2:I-、Br-、Fe2+
B.在含等物质的量的Fe3+、Cu2+、H+的溶液中加入Zn:Fe3+、Cu2+、H+、Fe2+
C.在含等物质的量的Ba(OH)2、KOH的溶液中通入CO2:KOH、Ba(OH)2、BaCO3、K2CO3
D.在含等物质的量的AlO2-、OH-、CO32-溶液中,逐滴加入盐酸:AlO2-、Al(OH)3、OH-、CO32-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年重庆市七校高一下学期期中联考化学试卷(解析版) 题型:选择题
原电池的电极名称不仅与电极材料的性质有关,也与电解质溶液有关。下列说法中正确的是
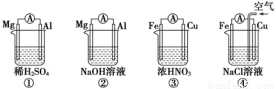
A.①②中Mg作负极,③④中Fe作负极
B.②中Mg作正极,电极反应式为:2H2O+2e-= 2OH-+H2↑
C.③中Fe作负极,电极反应式为Fe-2e-= Fe2+
D.④中Cu作正极,电极反应式为2H++2e-= H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com