
| A. | QCl2 | B. | RCl | C. | SCl3 | D. | TCl |
分析 由元素的电离能可以看出,Q的电离能很大,可能为零族元素,R和U的第一电离能较小,第二电离能剧增,故表现+1价,最外层电子数为1,二者位于同一族,S的第一、第二电离能较小,第三电离能剧增,故表现+2价,最外层电子数为2,T的第一、第二、第三电离能较小,第四电离能剧增,表现+3价,最外层电子数为3,
根据元素的化合价判断.
解答 解:由元素的电离能可以看出,Q的电离能很大,可能为零族元素,不能形成氯化物;
R和V的第一电离能较小,第二电离能剧增,故表现+1价,最外层电子数为1,二者位于同一族,其氯化物为RCl、VCl;
S的第一、第二电离能较小,第三电离能剧增,故表现+2价,最外层电子数为2,其氯化物为SCl2;
T的第一、第二、第三电离能较小,第四电离能剧增,表现+3价,最外层电子数为3,其氯化物为TCl3;
故选B.
点评 本题考查电离能知识,题目难度中等,注意原子的最外层电子数与电离能以及化合价的关系,注意根据化合价判断其氯化物的化学式.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同一原子中,2p,3p,4p能级的轨道依次增多 | |
| B. | 当碳原子的核外电子排布由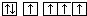 转变为 转变为 这一过程释放能量 这一过程释放能量 | |
| C. | 3p2表示3p能级有两个轨道 | |
| D. | 在同一能级上运动的电子,其运动状态可能相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
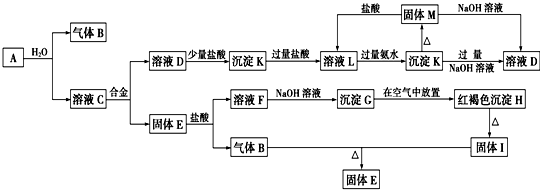
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
. .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
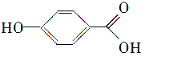
| A. | 苯分子中含有碳碳双键 | |
| B. | 烃是指只含有碳、氢元素的有机物 | |
| C. | 燃烧后能产生C02和H20的有机物一定是烃 | |
| D. | 葡萄糖溶液中加人新制Cu(OH)2悬浊液,振荡,产生砖红色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com