
 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�




�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010-2011ѧ���Ĵ�ʡ�ɶ��и�����һ������Լ�⣨���ۣ���ѧ���� ���ͣ������
�ݱ����������ض�����һ������£������˴�����ġ���ȼ����������Ҫ�Ǽ����ˮ�γɵ�ˮ���CH4��nH2O����
��1���ڳ��³�ѹ�£�����ȼ�����ᷢ���ֽⷴӦ���仯ѧ����ʽ�� ��
��2��������Ƴɺϳ�����CO��H2�������Ƴɼ״����������湩Ӧ���ŵ�ȼ�͡�
����101 KPaʱ��1��6 g CH4��g����H2O��g����Ӧ����CO��H2������20��64 kJ���������H2O��g����Ӧ���Ȼ�ѧ����ʽ�� ��
��CH4����ȫȼ��Ҳ���Ƶúϳ�����CH4��g��+ O2��g��===CO��g��+2H2��g����
O2��g��===CO��g��+2H2��g����
��H=-35.4 kJ��mol-1�����ԭ��ѡ�����Դ���ýǶȣ��ȽϷ����ٺ͢ڣ��ϳɼ״������˷���Ϊ������ţ���ԭ���� ��
�����¶�ΪT�����Ϊ10L���ܱ������У�����1 mol CO��2 mol H2��������Ӧ
CO��g��+ 2H2��g�� CH3OH��g������H=-Q kJ��mol-1��Q>O�����ﵽƽ����ѹǿ�ǿ�ʼʱѹǿ��0��6�����ų�����Q1kJ��
CH3OH��g������H=-Q kJ��mol-1��Q>O�����ﵽƽ����ѹǿ�ǿ�ʼʱѹǿ��0��6�����ų�����Q1kJ��
I��H2��ת����Ϊ ��
II������ͬ�����£�����ʼʱ���ܱ������м���a mol CH3 OH��g������Ӧƽ�����������Q2 kJ����Q1+Q2=Q����a= mol��
III����֪��ʼ��ƽ����COŨ����ʱ��ı仯��ϵ����ͼ��ʾ����t1ʱ�������Ϊ5L��ƽ���� ��Ӧ�����ƶ�����������桱����

����ͼ�л�����tl��ʼ���ٴδﵽƽ���
COŨ����ʱ��ı仯�������ߡ�
��3����CH4��Ƴ�ȼ�ϵ�أ��������ʸ��ߣ�װ��ʾ������ͼ��A��BΪ�����̼������

����ͨ�˼��飬�ڱ�״���£����ļ������VL��
��O<V��44��8 Lʱ������ܷ�Ӧ����ʽΪ ��
��44��8 L<V��89��6 Lʱ�������缫��ӦΪ ��
��V=67��2 Lʱ����Һ������Ũ�ȴ�С��ϵΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
�ݱ����������ض�����һ������£������˴�����ġ���ȼ����������Ҫ�Ǽ����ˮ�γɵ�ˮ���CH4��nH2O����
��1���ڳ��³�ѹ�£�����ȼ�����ᷢ���ֽⷴӦ���仯ѧ����ʽ�� ��
��2��������Ƴɺϳ�����CO��H2�������Ƴɼ״����������湩Ӧ���ŵ�ȼ�͡�
����101 KPaʱ��1��6 g CH4��g����H2O��g����Ӧ����CO��H2������20��64 kJ���������H2O��g����Ӧ���Ȼ�ѧ����ʽ�� ��
��CH4����ȫȼ��Ҳ���Ƶúϳ�����CH4��g��+![]() O2��g��===CO��g��+2H2��g����
O2��g��===CO��g��+2H2��g����
��H=-35.4 kJ��mol-1�����ԭ��ѡ�����Դ���ýǶȣ��ȽϷ����ٺ͢ڣ��ϳɼ״������˷���Ϊ������ţ���ԭ���� ��
�����¶�ΪT�����Ϊ10L���ܱ������У�����1 mol CO��2 mol H2��������Ӧ
CO��g��+ 2H2��g��![]() CH3OH��g������H=-Q kJ��mol-1��Q>O�����ﵽƽ����ѹǿ�ǿ�ʼʱѹǿ��0��6�����ų�����Q1kJ��
CH3OH��g������H=-Q kJ��mol-1��Q>O�����ﵽƽ����ѹǿ�ǿ�ʼʱѹǿ��0��6�����ų�����Q1kJ��
I��H2��ת����Ϊ ��
II������ͬ�����£�����ʼʱ���ܱ������м���a mol CH3 OH��g������Ӧƽ�����������Q2 kJ����Q1+Q2=Q����a= mol��
III����֪��ʼ��ƽ����COŨ����ʱ��ı仯��ϵ����ͼ��ʾ����t1ʱ�������Ϊ5L��ƽ���� ��Ӧ�����ƶ�����������桱����
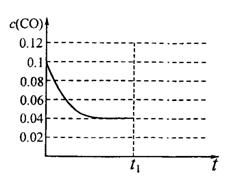
����ͼ�л�����tl��ʼ���ٴδﵽƽ���
COŨ����ʱ��ı仯�������ߡ�
��3����CH4��Ƴ�ȼ�ϵ�أ��������ʸ��ߣ�װ��ʾ������ͼ��A��BΪ�����̼������
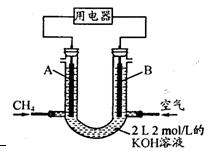
����ͨ�˼��飬�ڱ�״���£����ļ������VL��
��O<V��44��8 Lʱ������ܷ�Ӧ����ʽΪ ��
��44��8 L<V��89��6 Lʱ�������缫��ӦΪ ��
��V=67��2 Lʱ����Һ������Ũ�ȴ�С��ϵΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
�ݱ����������ض�����һ������£������˴�����ġ���ȼ����������Ҫ�Ǽ����ˮ�γɵ�ˮ���CH4��nH2O����
��1���ڳ��³�ѹ�£�����ȼ�����ᷢ���ֽⷴӦ���仯ѧ����ʽ�� ��
��2��������Ƴɺϳ�����CO��H2�������Ƴɼ״����������湩Ӧ���ŵ�ȼ�͡�
����101 KPaʱ��1��6 g CH4��g����H2O��g����Ӧ����CO��H2������20��64 kJ���������H2O��g����Ӧ���Ȼ�ѧ����ʽ�� ��
��CH4����ȫȼ��Ҳ���Ƶúϳ�����CH4��g��+![]() O2��g��===CO��g��+2H2��g����
O2��g��===CO��g��+2H2��g����
��H=-35.4 kJ��mol-1�����ԭ��ѡ�����Դ���ýǶȣ��ȽϷ����ٺ͢ڣ��ϳɼ״������˷���Ϊ������ţ���ԭ���� ��
�����¶�ΪT�����Ϊ10L���ܱ������У�����1 mol CO��2 mol H2��������Ӧ
CO��g��+ 2H2��g��![]() CH3OH��g������H=-Q kJ��mol-1��Q>O�����ﵽƽ����ѹǿ�ǿ�ʼʱѹǿ��0��6�����ų�����Q1kJ��
CH3OH��g������H=-Q kJ��mol-1��Q>O�����ﵽƽ����ѹǿ�ǿ�ʼʱѹǿ��0��6�����ų�����Q1kJ��
I��H2��ת����Ϊ ��
II������ͬ�����£�����ʼʱ���ܱ������м���a mol CH3 OH��g������Ӧƽ�����������Q2 kJ����Q1+Q2=Q����a= mol��
III����֪��ʼ��ƽ����COŨ����ʱ��ı仯��ϵ����ͼ��ʾ����t1ʱ�������Ϊ5L��ƽ���� ��Ӧ�����ƶ�����������桱����
����ͼ�л�����tl��ʼ���ٴδﵽƽ���
COŨ����ʱ��ı仯�������ߡ�
��3����CH4��Ƴ�ȼ�ϵ�أ��������ʸ��ߣ�װ��ʾ������ͼ��A��BΪ�����̼������
����ͨ�˼��飬�ڱ�״���£����ļ������VL��
��O<V��44��8 Lʱ������ܷ�Ӧ����ʽΪ ��
��44��8 L<V��89��6 Lʱ�������缫��ӦΪ ��
��V=67��2 Lʱ����Һ������Ũ�ȴ�С��ϵΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011���Ĵ�ʡ�ɶ��и�����һ������Լ�⣨���ۣ���ѧ���� ���ͣ������
�ݱ����������ض�����һ������£������˴�����ġ���ȼ����������Ҫ�Ǽ����ˮ�γɵ�ˮ���CH4��nH2O����
��1���ڳ��³�ѹ�£�����ȼ�����ᷢ���ֽⷴӦ���仯ѧ����ʽ�� ��
��2��������Ƴɺϳ�����CO��H2�������Ƴɼ״����������湩Ӧ���ŵ�ȼ�͡�
����101 KPaʱ��1��6 g CH4��g����H2O��g����Ӧ����CO��H2������20��64 kJ���������H2O��g����Ӧ���Ȼ�ѧ����ʽ�� ��
��CH4����ȫȼ��Ҳ���Ƶúϳ�����CH4��g��+ O2��g��===CO��g��+2H2��g����
O2��g��===CO��g��+2H2��g����
��H="-35.4" kJ��mol-1�����ԭ��ѡ�����Դ���ýǶȣ��ȽϷ����ٺ͢ڣ��ϳɼ״������˷���Ϊ������ţ���ԭ���� ��
�����¶�ΪT�����Ϊ10L���ܱ������У�����1 mol CO��2 mol H2��������Ӧ
CO��g��+ 2H2��g�� CH3OH��g������H="-Q" kJ��mol-1��Q>O�����ﵽƽ����ѹǿ�ǿ�ʼʱѹǿ��0��6�����ų�����Q1kJ��
CH3OH��g������H="-Q" kJ��mol-1��Q>O�����ﵽƽ����ѹǿ�ǿ�ʼʱѹǿ��0��6�����ų�����Q1kJ��
I��H2��ת����Ϊ ��
II������ͬ�����£�����ʼʱ���ܱ������м���a mol CH3 OH��g������Ӧƽ�����������Q2 kJ����Q1+Q2=Q����a= mol��
III����֪��ʼ��ƽ����COŨ����ʱ��ı仯��ϵ����ͼ��ʾ����t1ʱ�������Ϊ5L��ƽ���� ��Ӧ�����ƶ�����������桱����
����ͼ�л�����tl��ʼ���ٴδﵽƽ���
COŨ����ʱ��ı仯�������ߡ�
��3����CH4��Ƴ�ȼ�ϵ�أ��������ʸ��ߣ�װ��ʾ������ͼ��A��BΪ�����̼������
����ͨ�˼��飬�ڱ�״���£����ļ������VL��
��O<V��44��8 Lʱ������ܷ�Ӧ����ʽΪ ��
��44��8 L<V��89��6 Lʱ�������缫��ӦΪ ��
��V=67��2 Lʱ����Һ������Ũ�ȴ�С��ϵΪ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com