
【题目】N2O5是一种新型硝化剂,其性质和制备受到人们的关注。一定温度下,在2 L固定容积的密闭容器中发生反应:2N2O5(g)![]() 4NO2(g)+O2(g) ΔH>0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示。下列说法中,正确的是
4NO2(g)+O2(g) ΔH>0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示。下列说法中,正确的是

A.0~20 s内平均反应速率v(N2O5)=0.1 mol/(L·s)
B.10 s时,正、逆反应速率相等,达到平衡
C.20 s时,正反应速率大于逆反应速率
D.曲线a表示NO2的物质的量随反应时间的变化
科目:高中化学 来源: 题型:
【题目】某工厂的工业废水中含有大量的FeSO4 、较多的Cu2+和少量的Na+。为了减少污染并变废为宝,工厂计划从该废水回收硫酸亚铁和金属铜。请根据流程图,回答下列问题:

(1)物质X的化学式为________,操作1的名称:________
(2)写出A中主要成分的化学式:_____,在A中加入Y的离子方程式为:__________________
(3)工业废水中加入X所发生的离子方程式为:__________________________________;是否氧化还原反应____________(填“是”或“否”),如果是氧化还原反应,发生还原反应的是:______________(若非氧化还原反应则说明理由)。
(4)操作中的操作3是:___________、冷却结晶、过滤、洗涤、烘干。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用足量镁粉与一定量的某浓度的盐酸反应来制得氢气。由于反应速率太快,不易操作。为减慢反应速率,同时又不影响生成H2的总量,可向盐酸中加入的物质是
A.CH3COONa固体 B.NaOH溶液 C.(NH4)2SO4粉末 D.K2SO4固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氨的水溶液显弱碱性,其原因为___________________(用离子方程式表示), 0.1 molL-1的氨水中加入少量的NH4Cl固体,溶液的pH________(填“升高”或“降低”);若加入少量的明矾,溶液中的NH4+的浓度__________(填“增大”或“减小”);
(2)25℃,两种酸的电离平衡常数如下表。
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |
①HSO3-的电离平衡常数表达式K=___________________;
②0.10molL-1Na2SO3溶液中离子浓度由大到小的顺序为___________________;
③H2SO3溶液和NaHCO3溶液反应的离子方程式为___________________;
(3)银是一种贵金属,古代常用于制造钱币及装饰器皿,现代在电池和照明器材等领域亦有广泛应用。已知Ksp(AgCl)=1.8×10-10,若向5mL0.018molL-1的AgNO3溶液中加入5mL0.020molL-1的盐酸,混合后溶液中的Ag+的浓度为______molL-1,pH为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W代表原子序数依次增大的四种短周期主族元素,它们满足以下条件:①在元素周期表中,Z与Y、W均相邻;②X、Y、W分别位于不同周期;③Y、Z、W三种元素的原子最外层电子数之和为17.下列说法正确的是 ( )
A. X、Y、Z既能形成离子化合物,又能形成共价化合物
B. 元素的原子半径由小到大的顺序为r(Y)<r(Z)
C. X与其余三种元素之间形成的核外电子总数为10的微粒只有4种
D. H2Z的熔点比H2W高,是因为H2Z分子内存在氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向密闭容器中充入物质A和B,发生反应aA(g)+bB(g)![]() cC(g)。反应过程中,物质A的体积分数
cC(g)。反应过程中,物质A的体积分数
和C的体积分数随温度(T)的变化曲线如图所示。下列说法正确的是
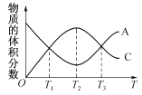
A.该反应在T1、T3温度时达到化学平衡 B.该反应在T2温度时达到化学平衡
C.该反应的逆反应是放热反应 D.升高温度,平衡会向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中主要含有Na+、K+、Mg2+、Ca2+、Cl-、Br-、SO42-、HCO3-、CO32-等离子,火力发电时排放的烟气可用海水脱硫,其工艺流程如下图所示,下列说法错误的是

A.海水pH约为8的原因主要是天然海水含CO32-、HCO3-
B.吸收塔中发生的反应有SO2+H2O![]() H2SO3
H2SO3
C.氧化主要是氧气将HSO3-、SO32-、H2SO3氧化为SO42-
D.经稀释“排放”出的废水中,SO42-浓度与海水相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质均既有离子键又有共价键的是( )
A. KOH、H2SO4、NH4Cl B. CaO、Na2CO3、NH4HCO3
C. K2O2、NaOH、K2SO4 D. HClO、Al2O3、MgCl2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com