
下表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是
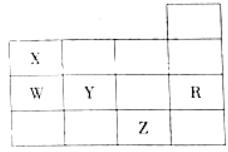
A.常压下五种元素的单质中Z单质的沸点最高
B.Y、Z的阴离子电子层结构都与R原子的相同
C.W的氢化物的沸点比X的氢化物的沸点高
D.Y元素的非金属性比W元素的非金属性强
 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案科目:高中化学 来源: 题型:
X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。
回答下列问题:
⑴ L的元素符号为________ ;M 在元素周期表中的位置为________________;五种元素的原子半径从大到小的顺序是____________________(用元素符号表示)。
在元素周期表中的位置为________________;五种元素的原子半径从大到小的顺序是____________________(用元素符号表示)。
⑵ Z、X两元素按原子数目比l ∶3和2∶4构成分子A和B,A的电子式为___,B的结构式为____________。
∶3和2∶4构成分子A和B,A的电子式为___,B的结构式为____________。
⑶ 硒(se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为_______,其最高价氧化物对应的水化物化学式为_______。该族2 ~ 5周期元素单质分别与H2反应生成l mol气态氢化物的反应热如下,表示生成1 mol硒化氢反应热的是__________(填字母代号)。
a.+99.7 mol·L-1 b.+29.7 mol·L-1 c.-20.6 mol·L-1 d.-241.8 kJ·mol-1
⑷ 用M单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R,R受热分解生成化合物Q 。写出阳极生成R的电极反应式:______________;由R生成Q的化学方程式:_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E代表5种元素。请填空:
(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为 ;
(2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B的元素符号为 ,C的元素符号为 ;
,C的元素符号为 ;
(3)D元素的正三价离子的3d亚层为半充满,D的元素符号为 ,其基态原子的电子排布式为 。
(4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E的元素符号为 ,其基态原子的电子排布式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z和W代表原子序数依次增大的四种短周期元素,它们满足以下条件:
①元素周期表中,Z与Y相邻,Z与W相邻;
②Y、Z和W三种元素的原子最外层电子数之和为17。
请填空:
(1)Y、Z和W三种元素是否位于同一周期(填“是”或“否”): ,理由是 ;
(2)Y是 ,Z是 ,W是 ;
(3)X、Y、Z和W可组成一化合物,其原子个数之比为8∶2∶4∶1。写出该化合物的名称及化学式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D四种短周期元素的原子半径依次减小,A与C的核电荷数之比为3:4,D能分别与A、B、C形成电子总数相等的分子X、Y、Z。下列叙述正确的是
A.X、Y、Z的稳定性逐渐减弱
B.A、B、C、D只能形成5种单质
C.X、Y、Z三种化合物的熔沸点逐渐升高
D.自然界中存在多种由A、B、C、D四种元素组成的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于元素周期表的说法中正确的是
A.同一主族元素的原子序数的差不可能为10
B.同周期第ⅡA族与第ⅢA族元素的原子序数差值一定是1
C.催化剂一般在金属与非金属的分界线处寻找
D.过渡元素全部是金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W是短周期元素,X元素原子的最外层未达到8电子稳定结构,工业上通过分离液态空气获得其单质;Y元素原子最外电子层上s、p电子数相等;Z元素+2价阳离子的核外电子排布与氖原子相同;W元素原子的M层有1个未成对的p电子。下列有关这些元素性质的说法一定正确的是
A.X元素的氢化物的水溶液显碱性
B.Z元素的离子半径大于W元素的离子半径
C.Z元素的单质在一定条件下能与X元素的单质反应
D.Y元素最高价氧化物的晶体具有很高的熔点和沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
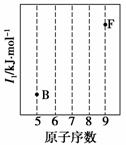
依据第二周期元素第一电离能的变化规律,参照下图B、F元素的位置,用小黑点标出C、N、O三种元素的相对位置。
(2)(2013·浙江)①N、Al、Si、Zn四种元素中,有一种元素的电离能数据如下:
| 电离能 | I1 | I2 | I3 | I4 | …… |
| In/kJ·mol-1 | 578 | 1 817 | 2 745 | 11 578 | …… |
则该元素是________(填写元素符号)。
②基态锗(Ge)原子的电子排布式是________________________________________。
Ge的最高价氯化物的分子式是________。
③Ge元素可能的性质或应用有________。
A.是一种活泼的金属元素
B.其电负性大于硫
C.其单质可作为半导体材料
D.其最高价氯化物的沸点低于其溴化物的沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
已知2SO2(g) + O2(g)  2SO3(g); △H= -197 kJ/ mol,如果反应在密闭容器中进行,下述有关说法中正确的是
2SO3(g); △H= -197 kJ/ mol,如果反应在密闭容器中进行,下述有关说法中正确的是
A.达到平衡时,SO2的浓度与SO3的浓度相等
B.相同状况下,反应2SO3(g)  2SO2(g)+O2(g)是一个吸热反应
2SO2(g)+O2(g)是一个吸热反应
C.在密闭容器中加入2molSO2和1molO2充分反应后放出197KJ的热量
D.升高温度,吸热反应的速率增大,放热反应的速率减少
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com