
【题目】根据题意解答
(1)苯、四氯化碳、乙醇都是常见的有机溶剂.能与水互溶的是;难溶于水,且密度比水小的是 .
(2)现有化合物: 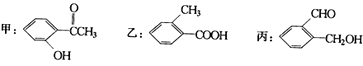
①请写出丙中含氧官能团的名称: .
②请判别上述哪些化合物互为同分异构体:(填代号).
(3)同温同压下,相同体积某烷烃的蒸气质量是氢气质量的36倍,该烃的分子式为 , 写出该烃的所有同分异构体的结构简式: .
【答案】
(1)乙醇;苯
(2)醛基、羟基;C5H12
(3)C5H12;CH3CH2CH2CH2CH3、CH3CH2CH(CH3)2、C(CH3)4
【解析】解:(1)乙醇能与水互溶,苯、四氯化碳难溶于水,苯的密度比水小,四氯化碳的密度比水的大, 所以答案是:乙醇;苯;(2)①由丙的结构简式,可知含有的官能团为:醛基、羟基,所以答案是:醛基、羟基;②甲、乙、丙的分子式均相同,含有的官能团种类不同,三者互为同分异构体,所以答案是:甲、乙、丙;(3)某烷烃的蒸气质量是氢气质量的36倍,则其相对分子质量为36×2=72,烷烃的组成通式为CnH2n+2 , 则14n+2=72,解得n=5,故该烷烃的分子式为:C5H12 , 可能的结构简式有:CH3CH2CH2CH2CH3、CH3CH2CH(CH3)2、C(CH3)4 ,
所以答案是:C5H12;CH3CH2CH2CH2CH3、CH3CH2CH(CH3)2、C(CH3)4 .
【考点精析】掌握有机物的结构和性质是解答本题的根本,需要知道有机物的性质特点:难溶于水,易溶于汽油、酒精、苯等有机溶剂;多为非电解质,不易导电;多数熔沸点较低;多数易燃烧,易分解.


科目:高中化学 来源: 题型:
【题目】由H、Na、Mg、S、O、Cl六种元素组成的物质,按要求,每小题各写出一个化学方程式
(1)是化合反应又是氧化还原反应的 .
(2)是分解反应又是氧化还原反应的 .
(3)是氧化还原反应又是置换反应的 .
(4)写出酸性氧化物与可溶性碱反应的化学方程式 .
(5)写出碱性氧化物与水反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X,Y,Z,W均为短周期元素,它们在元素周期表中相对位置如图所示,已知W原子的最外层电子数比内层电子数少3 个,下列说法正确的是( ) 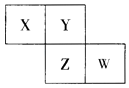
A.氧化物对应水化物酸性W比Z强
B.Y单质与Z的氢化物水溶液反应,有沉淀生成
C.X单质氧化性强于Y单质
D.简单离子的半径:Z<W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图是一些含氯产品. 
(1)储氯钢瓶中应贴的标签为 . a.易燃品 b.爆炸品 c.有毒品
(2)漂白粉的有效成分是(填化学式),其与空气中的反应可得到具有漂白能力的次氯酸.
(3)“84”消毒液的有效成分是次氯酸钠,“84”消毒液与除垢剂(有效成分为盐酸)混合使用会产生黄绿色、有刺激性气味的气体,该反应的离子方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Zn还原SiCl4的反应如下:下列说法正确的是( )
SiCl4(g)+2Zn(l)Si(s)+2ZnCl2(g)△H1
SiCl4(g)+2Zn(g)Si(s)+2ZnCl2(g)△H2 .
A.Zn(l)=Zn(g)△H= ![]() (△H1﹣△H2 )
(△H1﹣△H2 )
B.用硅制作的太阳能电池是将化学能转化为电能
C.增加Zn(g)的量,△H2变大
D.以Zn片、铜片和稀硫酸构成的原电池,Zn片表面有气泡产生.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是小王在医院做的血常规检查报告单的部分内容.小王应注意补充的微量元素是( )
序号 | 项目 | 结果 | 正常范围 | 单位 |
1 | 红细胞计数 | 2.3 | 3.5~5 | ×1012/L |
2 | 血红蛋白 | 75 | 110~150 | g/L |
3 | 血小板计数 | 205.0 | 100~300 | ×109/L |
A.硒
B.锌
C.铁
D.碘
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁、钴(Co)、镍(Ni)是同族元素,都是较活泼的金属,它们的化合物在工业上有重要的应用.
(1)草酸钴(CoCO)是一种难溶于水的浅粉红色粉末,通常用硫酸钴溶液和草酸铵溶液反应制得,写出该反应的离子方程式:
(2)现将含0.5mol FeCl3的溶液和含0.5mol KSCN的溶液混合,混合后溶液体积为1L,已知溶液存在平衡:Fe3++SCN﹣Fe(SCN)2+(忽略其它过程).平衡浓度c[Fe(SCN)2+]与温度T的关系如图1所示:则该反应△H0(填“>”或“<”),温度为T1时,反应在5秒钟时达到平衡,平衡时c[Fe(SCN)2+]=0.45mol/L,求达到平衡时的平均反应速率
v(SCN﹣)=molL﹣1S﹣1 , 该温度下的Fe3+的平衡转化率为 , 该温度下反应的平衡常数为 . 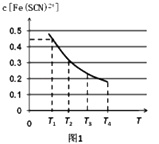
(3)已知某溶液中,Co2+、Ni2+的浓度分别为0.60mol/L和1.2mol/L,取一定量的该溶液,向其中滴加NaOH溶液,当Co(OH)2开始沉淀时,溶液中 ![]() 的值等于 . (取两位有效数字)
的值等于 . (取两位有效数字)
(已知Ksp[Co(OH)2]=6.0×10﹣15 , Ksp[Ni(OH)2]=2.0×10﹣15)
(4)工业上还可用通过电解浓NaOH溶液制备Na2FeO4 , 其工作原理如图2所示,则阳极的电极反应式为 . 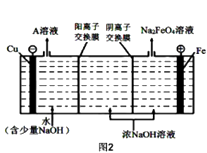
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X、Y、Z原子序数之和为37,X、Y在同一周期,X+与Z-具有相同的核外电子层结构。下列推测不正确的是
A. 同周期元素中X的金属性最强 B. 同族元素中Z的氢化物稳定性最高
C. 原子半径X>Y,离子半径X+>Z- D. 同周期元素中Y的最高价含氧酸的酸性最强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com