
 A、B、C、D、E、F是元素周期表中前四周期的元素,原子序数依次增大,A、B是相邻的同一短周期元素,其中A元素所形成的化合物种类最多.C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数目相差10.基态D、E原子的价电子层中未成对电子数分别为4、2.且原子序数相差2,其中D元素是生产、生活中常见的金属.
A、B、C、D、E、F是元素周期表中前四周期的元素,原子序数依次增大,A、B是相邻的同一短周期元素,其中A元素所形成的化合物种类最多.C、D、E、F是位于同一周期的金属元素,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数目相差10.基态D、E原子的价电子层中未成对电子数分别为4、2.且原子序数相差2,其中D元素是生产、生活中常见的金属.分析 A、B是相邻的同一短周期元素,其中A元素所形成的化合物种类最多是碳,所以B是氮元素,C、D、E、F是位于同一周期的金属元素,只能处于第四周期,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,可推知C为K、F为Cu,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2,D、E价电子排布分别为3d64s2,3d84s2,故D为Fe、E为Ni,据此解答.
解答 解:前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A、B属于同一短周期元素且相邻,A元素所形成的化合物种类最多,则A为碳元素、B为N元素;C、D、E、F是位于同一周期的金属元素,只能处于第四周期,基态C、F原子的价电子层中未成对电子均为1个,且C、F原子的电子数相差为10,可推知C为K、F为Cu,基态D、E原子的价电子层中未成对电子数分别为4、2,且原子序数相差为2,D、E价电子排布分别为3d64s2,3d84s2,故D为Fe、E为Ni,
(1)非金属性越强电负性越大,故电负性最大的是N,K的核外电子排布为:【Ar】4S1,
故答案为:N;【Ar】4S1;
(2)黄血盐的化学式K4[Fe(CN)6],CN-与氮气互为等电子体,CN-中存在C≡N三键,故1mol HCN中含有π键的数目为2NA,和σ键的数目为2NA,所以之比为1:1,黄血盐晶体中含有离子键、配位键、共价键,没有金属键、氢键、分子间的作用力,
故答案为:1:1;ab;
(3)根据HCHO碳原子含有3个σ键,所以碳原子采取的杂化方式为sp2; HCHO中碳原子含有3个σ键,不含孤电子对,所以其空间构型是平面三角形,加成产物CH3OH分子之间能形成氢键熔、沸点比CH4的熔、沸点高,故答案为:sp2;平面三角形;加成产物CH3OH分子之间能形成氢键;
(4)金属K晶体为体心立方堆积,晶胞结构为图Ⅰ,晶胞中K原子配位数为8,金属Cu晶体为面心立方最密堆积,晶胞结构为图Ⅱ,以顶点Cu原子研究与之最近的原子位于面心,每个顶点Cu原子为12个面共用,晶胞中Cu原子配位数为12,K、Cu两种晶体晶胞中金属原子的配位数之比为 8:12=2:3;
金属K的晶胞中,K原子数目=1+8×$\frac{1}{8}$=2,若K原子的摩尔质量为M,阿伏加得罗常数为NA,则晶胞质量=$\frac{2×M}{NA}$g,设该晶胞的密度为a g/cm3,则晶胞体积=$\frac{\frac{2M}{NA}g}{a\\;g/c{m}^{3}}$=$\frac{2M}{aNA}$cm3,晶胞棱长=$\root{3}{\frac{2M}{a{N}_{A}}}$cm,设K原子半径为r,则晶胞体对角线长度=4r,故3($\root{3}{\frac{2M}{a{N}_{A}}}$cm)2=(4r)2,故r=$\frac{\sqrt{3}}{4}\root{3}{\frac{2M}{a{N}_{A}}}$cm,
故答案为:2:3;$\frac{\sqrt{3}}{4}\root{3}{\frac{2M}{a{N}_{A}}}$.
点评 本题是对物质结构的考查,涉及元素推断、核外电子排布、电负性、化学键、杂化轨道、晶胞计算等,较好的考查物质结构的主干知识,(4)为易错点、难点,需要学生熟记晶胞结构,对学生的空间想象及数学计算具有一定的要求,难点中等.


 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:选择题

| A. | 其分子为C8H8O2•H2O | |
| B. | 该物质属于水合物 | |
| C. | 1 mol该物质可与3 mol H2发生加成反应 | |
| D. | 该有机物属于芳香烃类 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该电池不宜在高温下工作 | |
| B. | 若该电池为酸性介质,正极反应式为:O2+4e-+4H+═2H2O | |
| C. | 放电过程中,电池内阳离子向正极迁移 | |
| D. | 若该电池为碱性介质,以葡萄糖为原料并完全氧化,负极反应式为:C6H12O6-24e-+6H2O═6CO2↑+24H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用LED照明灯属于“低碳生活”方式 | |
| B. | 在家用电热水器不锈钢内胆镶嵌镁棒,以防止内胆被侵蚀 | |
| C. | 施用适量石灰乳可降低盐碱地(含较多NaCl,Na2CO3) | |
| D. | 研制高性能的耐磨轮胎,可减少细颗粒物(PM2.5)的产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO为氧化产物,H2为还原产物 | B. | CaCN2含有共价键,属于共价化合物 | ||
| C. | HCN既是氧化剂又是还原剂 | D. | 每消耗10g CaCO3生成2.24L CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
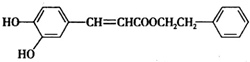
| A. | 能使KMnO4溶液褪色 | |
| B. | 1mol的该化合物和足量的钠反应生成1molH2 | |
| C. | 能与溴发生取代反应和加成反应 | |
| D. | 1mol该化合物最多与2molNaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
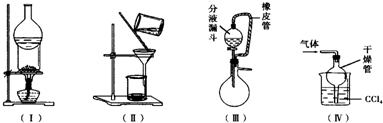 下列实验装置用途正确的是( )
下列实验装置用途正确的是( )| A. | 装置(Ⅰ)可用于I2与NH4Cl混合物的分离 | |
| B. | 装置(Ⅱ)用于分离Fe(OH)3胶体和FeCl3溶液 | |
| C. | 装置(Ⅲ)橡皮管起到平衡气压,使液体顺利流下的作用 | |
| D. | 装置(Ⅳ)用于吸收HCl或NH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com