
| ① | ② | ③ | ④ | |
| 氨水 | 氢氧化钠 | 醋酸 | 盐酸 | |
| pH | 11 | 11 | 3 | 3 |
| A. | 分别加水稀释10倍,四种溶液的pH为:①>②>③>④ | |
| B. | 温度上升10℃,四种溶液的pH不变 | |
| C. | ③④中分别加入适量的氯化按晶体后,③的pH减小,④的pH不变 | |
| D. | 将①④两种溶液等体积混合,所得溶液中c (C1-)>c NH4+)>c (H+)>c (OH-) |
分析 A.从加水促进弱电解质的电离的角度分析;
B.弱电解质的电离是吸热过程,温度升高,可以促进弱电解质的电离,且水的离子积增大
C.根据弱电解质的电离平衡影响因素分析;
D.氨水平衡状态下电离出的氢氧根离子浓度和盐酸溶液中的氢离子浓度相等,等体积混合反应,氨水过量,溶液呈碱性.
解答 解:A.①氨水pH=11,平衡状态下氢氧根离子浓度为10-3mol/L;②氢氧化钠pH=11,氢氧根离子浓度为10-3mol/L;③醋酸pH=3,平衡状态下氢离子浓度为10-3mol/L;④硫酸pH=3,溶液中氢离子浓度为10-3mol/L;分别加水稀释10倍、四种溶液的pH大小为,碱比酸的pH大,弱碱弱酸存在电离平衡,加水稀释比强酸强碱的pH变化小,所以得到①>②>④>③,故A正确;
B.升高温度,水的离子积增大,弱电解质的电离程度增大,所以氨水中氢氧根离子浓度增大,溶液pH增大;氢氧化钠溶液中氢氧根离子浓度不变,水的离子积增大,溶液中氢离子浓度增大,溶液pH减小;醋酸溶液中,醋酸的电离程度增大,溶液中氢离子浓度增大,溶液的pH减小;盐酸溶液中氢离子浓度不变,溶液的pH不变,故B错误;
C.在③④中分别加入适量的醋酸铵晶体后,③中溶解形成的醋酸根离子对醋酸弱电解质的电离平衡起到了抑制作用,氢离子浓度减小,pH增大;④中溶解的醋酸根离子与氢离子会结合成弱电解质醋酸,减小了氢离子的浓度,pH增大,故C错误;
D.将①氨水PH=11,平衡状态下氢氧根离子浓度为10-3mol/L④盐酸PH=3,溶液中氢离子浓度为10-3mol/L两种溶液等体积混合,氨水中平衡状态下的氢氧根离子与盐酸中的氢离子恰好反应,氨水又电离出氢氧根离子和铵根离子,依据电离方程式NH3•H20?NH4++OH-;HCl=H++Cl-,可知c(Cl-)=5×10-4mol/L,c(NH4+)>5×10-4mol/L,c(OH-)>c(H+),综上所述可知溶液中的离子浓度大小c(NH+4)>c(Cl-)>c(OH-)>c(H+),故D错误.
故选A.
点评 本题综合考查较为综合,涉及酸碱混合的定性判断、离子浓度大小比较,综合考查学生的分析能力,为高考常见题型和高频考点,注意把握弱电解质的电离特点,难度中等.


 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:选择题
| A. | ①②③⑧ | B. | ②③⑥⑦ | C. | ①③⑥⑦ | D. | ①④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称取35.20g NaOH | |
| B. | 用10mL量筒量取8.50mL浓盐酸配一定物质的量浓度溶液 | |
| C. | 用25ml滴定管量取15.80ml浓溶液配一定物质的量浓度溶液 | |
| D. | 用pH试纸测得溶液pH为4.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg(OH)2+2HCl═MgCl2+2H2O | B. | 2NaOH+H2SO4═Na2SO4+2H2O | ||
| C. | Ba(OH)2+H2SO4═BaSO4↓+2H2O | D. | CH3COOH+NaOH═CH3COONa+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该氧原子的摩尔质量为$\frac{12b}{a}$g/mol | B. | 1 mol 该氧原子质量为幽a NAg | ||
| C. | xg 该氧原子所含的电子数为$\frac{16x}{a}$ | D. | yg 该氧原子的中子数一定为$\frac{8y}{a}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
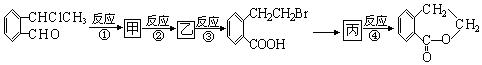
 +O2$\stackrel{催化剂}{→}$2
+O2$\stackrel{催化剂}{→}$2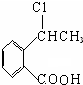 ,氧化反应.
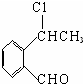
,氧化反应. +NaOH$→_{△}^{CH_{3}CH_{2}OH}$
+NaOH$→_{△}^{CH_{3}CH_{2}OH}$ +NaCl+H2O,消去反应.
+NaCl+H2O,消去反应. →丙实际需要两步才能完成,写出第一步反应的化学方程式
→丙实际需要两步才能完成,写出第一步反应的化学方程式 +2NaOH$→_{△}^{H_{2}O}$
+2NaOH$→_{△}^{H_{2}O}$ +NaBr+H2O,第二步所用试剂及目的是试剂是盐酸,目的是将钠盐酸化生成对应的酸.
+NaBr+H2O,第二步所用试剂及目的是试剂是盐酸,目的是将钠盐酸化生成对应的酸.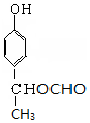 和
和 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在该反应条件下,Mg的还原性强于C的还原性 | |
| B. | Mg、MgO中镁元素微粒的半径:r(Mg2+)<r(Mg) | |
| C. | 元素C 在自然界中既有游离态又有化合态 | |
| D. | 该反应中化学能全部转化为热能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com