
【题目】苯和甲苯相比,下列叙述不正确的是( )
A. 都属于芳香烃 B. 都能使酸性高锰酸钾溶液褪色
C. 都能在空气中燃烧 D. 都能发生取代反应
科目:高中化学 来源: 题型:
【题目】下列物质性质与对应用途错误的是( )
A. Na2FeO4有强氧化性,还原产物又易水解成胶体,是自来水理想的消毒剂和净水剂
B. 晶体硅因熔点高硬度大,常用作芯片
C. 氮气的化学性质稳定,常用作粮食的保护气
D. AgBr有感光性,常用作胶片和太阳镜中的感光剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,空气之中少量的NO2能参与硫酸型酸雨的形成,反应过程如下:
①SO2+NO2=SO3+NO ②SO3+H2O=H2SO4 ③2NO+O2=2NO2 NO2在上述过程中的作用,与H2SO4在下列变化中的作用相似的是
A. 潮湿的氯气通过盛有浓H2SO4的洗气瓶 B. 硫化氢通入浓H2SO4中
C. 浓H2SO4滴入萤石中,加热 D. 加入少量H2SO4使乙酸乙酯水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分类结果全部正确的是( )
A. 水煤气-混合物 胆矾-纯净物 臭氧-单质
B. 纯碱-碱 硫化氢-酸 小苏打-酸式盐
C. 油脂-高分子化合物 纤维素-天然高分子化合物 有机玻璃-合成高分子化合物
D. 液氯-非电解质 硫酸钡-强电解质 醋酸-弱电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过对煤的综合利用可得到洁净的燃料和多种化工原料,也可减少环境呢污染。煤的间接液化可得到甲醇。
(1)已知:CH3OH、H2的燃烧热(△H)分别为-726.5kJ/mol、-285.8kJ/mol,则常温下CO2和H2反应生成CH3OH和H2O的热化学方程式是____________。
(2)一定条件下,CO和H2合成CH3OH:CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
①在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。
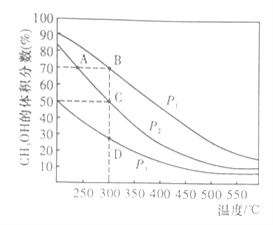
A、B、C三点平衡常数KA、KB、KC的大小关系是___________;压强:P1____P2(填“>”、“<”或“=”)
逆反应速率:v逆(A)______v逆(B)(填“>”、“<”或“=”)
在C点,CO的转化率为__________;
在C点,若再按物质的量之比1:2充入一定量的CO和H2,当其它条件不变,达到新的平衡时,CH3OH的体积分数__________(填“增大”、“减小”或“不变”)。
②若在恒温恒容条件下,能表示该可逆反应达到平衡状态的有__________。
A. 混合气体的密度保持不变
B. 混合气体的平均相对分子质量保持不变
C. 容器内的压强保持不变
D. 单位时间内每消耗1molCO的同时,生成2molH2
E. CO、H2、CH3OH的浓度保持不变
F. CO、H2、CH3OH的浓度之比为1:2:1
(3)氢硫酸、碳酸均为二元弱酸,其常温下的电离常数如下表:
H2CO3 | H2S | |
Ka1 | 4.4×10-7 | 1.3×10-7 |
Ka2 | 4.7×10-11 | 7.1×10-15 |
煤的气化过程中产生的有害气体H2S可用足量的Na2CO3溶液吸收,该反应的离子方程式为________;常温下,0.1mol·L-1NaHCO3溶液和0.1mol·L-1NaHS溶液的pH相比,pH较小的为______溶液(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列事实的解释正确的是
A. 氯气可以使湿润的有色布条褪色,是因为氯气具有漂白性
B. 分别用盛满HC1气体和盛满NO2气体的烧瓶做喷泉实验,喷泉结束后,所得溶液的物质的量浓度相同
C. 向50mL 18 mol/L的H2SO4溶液中加入足量的铜片加热充分反应后,被还原的H2SO4的物质的量等于0.45 mol
D. 常温下,浓硝酸可以用铝制容器贮存,说明铝与浓硝酸不反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,已知下列各反应为放热反应,下列各热化学方程式中ΔH最小的是
A. 2A(l)+B(l)==="2C(g)" ΔH1 B. 2A(g)+B(g)==="2C(l)"ΔH2
C. 2A(g)+B(g)==="2C(g)" ΔH3 D. 2A(l)+B(l)==="2C(l)" ΔH4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应 Fe(s) + CO2(g) ![]() FeO(s) + CO(g),△H=aKJ﹒mol-1,平衡常数为K。测得在不同温度下,K值如下:
FeO(s) + CO(g),△H=aKJ﹒mol-1,平衡常数为K。测得在不同温度下,K值如下:
温度/℃ | 500 | 700 | 900 |
K | 1.00 | 1.47 | 2.4 |
(1)若500℃时进行反应①,CO2的起始浓度为2mol﹒L-1,CO的平衡浓度为__________。
(2)该反应为__________(选填“吸热”或“放热”)反应。
(3)700℃时反应达到平衡,要使该平衡向右移动,其他条件不变时,可以采取的措施有__________(填序号)。
A.缩小反应器体积 B.CO2 C.升高温度到900℃ D.使用合适的催化剂
E.增加Fe的量
(4)下列图像符合该反应的是__________(填序号)(图中v为速率,φ为混合物中CO含量,T为温度且T1>T2)。
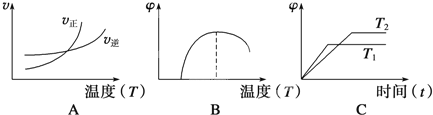
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com