
【题目】A、B、C、D、E是五种短周期元素,F是过渡元素。A、B、C、E同周期,C、D同主族,A元素在地壳含量中排名第二,B是同周期第一电离能最小的元素,C原子的最外层有三个未成对电子,E单质常温下为淡黄色固体,F的外围电子排布式为3d64s2。回答下列问题:
(1)写出下列元素的名称:A B 。
(2)B、C、E第一电离能由大到小的顺序是 (用元素符号作答)。
(3)写出D元素原子构成单质的电子式 ,D的简单气态氢化物的空间构型为 。
(4)F元素在周期表中的位置为 ,其形成的简单离子F3+的核外电子排布式为 。
【答案】(1)硅;钠(2)P>S>Na(3)![]() ;三角锥形
;三角锥形
(4)第四周期第Ⅷ族;[Ar] 3d5或1s22s22p63s23p63d5
【解析】试题分析:A、B、C、D、E是五种短周期元素,F是过渡元素。A、B、C、E同周期,C、D同主族,A元素在地壳含量中排名第二,则A是Si。B是同周期第一电离能最小的元素,因此B是Na。C原子的最外层有三个未成对电子,则C是P,所以D是N。E单质常温下为淡黄色固体,因此E是S。F的外围电子排布式为3d64s2,因此F是Fe。
(1)根据以上分析可知A是硅,B是钠。
(2)非金属性越强,第一电离能越大,由于P元素的3p轨道电子处于半充满状态,稳定性强,所以B、C、E第一电离能由大到小的顺序是P>S>Na。
(3)写出D元素原子构成单质是氮气,其电子式为![]() ,D的简单气态氢化物氨气分子的空间构型为三角锥形。
,D的简单气态氢化物氨气分子的空间构型为三角锥形。
(4)Fe元素在周期表中的位置为第四周期第Ⅷ族,其形成的简单离子Fe3+的核外电子排布式为[Ar] 3d5或1s22s22p63s23p63d5。


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 化学反应过程中一定伴随着能量的变化
B. 自然界中存在不需要活化能推动的反应
C. H+和OH-在水溶液中的反应,需要的活化能较高
D. 有效碰撞应当是本身具有较高能量的分子之间的碰撞
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中进行如下反应:2SO2(气)+O2(气)![]() 2SO3(气),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是( )
2SO3(气),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是( )
A.SO2为0.4mol/L、O2为0.2mol/L B.SO2为0.25mol/L
C.SO2、SO3均为0.15mol/L D.SO3为0.4mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.0.012kg12C所含的碳原子数就是阿伏伽德罗常数
B.等质量的O2和O3中所含氧原子的物质的量相同
C.等物质的量的分子所含原子数目一定相等
D.标准状况下,1molH2的体积约为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从实验室加热氯酸钾与MnO2的混合物制氧气后的剩余物中回收二氧化锰的操作顺序正确的是
A.溶解、过滤、蒸发、洗涤 B、溶解、过滤、洗涤、干燥
C.溶解、蒸发、洗涤、过滤、 D.溶解、洗涤、过滤、干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)以下反应:①木炭与水制备水煤气 ②氯酸钾分解 ③炸药爆炸 ④酸与碱的中和反应 ⑤生石灰与水作用制熟石灰 ⑥ Ba(OH)2·8H2O与NH4Cl,属于放热反应的是 (填序号),写出反应⑥的化学方程式__ 。
(二)为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施.化学反应的焓变通常用实验进行测定,也可进行理论推算。
(1)丙烯是石化工业的主要原料之一,由于市场对丙烯的需求量激增,丙烷脱氢制丙烯的技术日益受到重视。某研究机构需得到C3H8(g)===3C(石墨,s)+4H2(g)的ΔH,但直接测定实验难进行,可通过下图中各组物质能量总和及相互间转化中的能量变化计算得到:

①判断:ΔH________0(选填“>”、“<”或“=”)。
②ΔH=___________(用含ΔH1、ΔH2、ΔH3的代数式表示)。
(2)实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式:_________________。
(3)由气态基态原子形成1mol化学键释放的最低能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的断裂和生成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.已知反应N2(g)+3H2(g)![]() 2NH3(g) △H=a kJ·mol-1。试根据表中所列键能数据计算a的数值: (写出 + 或-)。[
2NH3(g) △H=a kJ·mol-1。试根据表中所列键能数据计算a的数值: (写出 + 或-)。[
化学键 | H-H | N-H | N≡N |
键能/kJ·mol-1 | 436 | 391 | 945 |
(4)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算。
已知:C(石墨,s)+O2(g)=CO2(g) △H1=-393.5kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H2=-571.6kJ·mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H3=-2599kJ·mol-1
根据盖斯定律,计算298K时由C(石墨,s)和H2(g)生成C2H2(g)反应的反应的热化学方程式: _ _ _。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,某容积固定的密闭容器由可移动的活塞隔成A、B两室,分别向A、B两室充入H2、O2的混合气体和1 mol空气,此时活塞的位置如图所示。
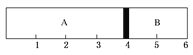
(1)A室混合气体的物质的量为________,所含分子总数为________。
(2)实验测得A室混合气体的质量为34 g,则该混合气体的密度是同温同压条件下氦气密度的________倍。
(3)若将A室H2、O2的混合气体点燃引爆,恢复原温度后,最终活塞停留的位置在________刻度,容器内气体压强与反应前气体压强之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关原电池的说法中正确的是( )
A.电极一定要由两种不同的金属组成
B.电子流出的一极是正极
C.两极均发生氧化还原反应
D.由化学能转化为电能的装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产生活中处处有化学,化学是人类进步的关键。下列表述错误的是
A. 汽车排放的尾气和冬季取暖排放的颗粒污染物是形成雾霾的一个因素
B. 泡沫灭火器中用的是小苏打和硫酸铝
C. 用活性炭为糖浆脱色和用臭氧漂白纸浆,二者所用原理相同
D. 从海水中可提取镁,电解熔融氯化镁可制得金属镁
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com