
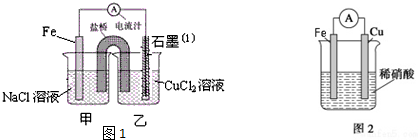
 已知甲酸(HCOOH)是羧酸中组成最简单的酸,它具有羧酸的性质,在实验室里常用甲酸在浓硫酸的作用下制取少量一氧化碳,现用甲酸与甲醇反应制取甲酸甲酯来验证甲酸具有能发生酯化反应的性质,装置如图所示.
已知甲酸(HCOOH)是羧酸中组成最简单的酸,它具有羧酸的性质,在实验室里常用甲酸在浓硫酸的作用下制取少量一氧化碳,现用甲酸与甲醇反应制取甲酸甲酯来验证甲酸具有能发生酯化反应的性质,装置如图所示.分析 (1)甲酸与甲醇发生酯化反应生成甲酸甲酯和水;
(2)还要饱和碳酸钠溶液分离混合物,碎瓷片防止暴沸;
(3)若导管a伸入液面以下,醇、酸易溶于水,易发生倒吸;
(4)该实验中可能产生有毒尾气,不能直接排放在环境中;
(5)大试管中溶液的作用有溶解甲醇、吸收甲酸,还可降低酯的溶解度,偏于分层;
(6)酯在NaOH溶液中可发生水解反应.
解答 解:(1)生成甲酸甲酯反应的化学方程式为HCOOH+CH3OH$→_{△}^{浓H_{2}SO_{4}}$HCOOCH3+H2O,故答案为:HCOOH+CH3OH$→_{△}^{浓H_{2}SO_{4}}$HCOOCH3+H2O;
(2)实验过程中选用的试剂及用品有浓硫酸、甲醇、甲酸,还有饱和Na2CO3溶液、碎瓷片(或沸石),故答案为:饱和Na2CO3溶液;碎瓷片(或沸石);
(3)导管a不能伸入液面以下的理由是防止液体受热不均匀引起倒吸,故答案为:防止液体受热不均匀引起倒吸;
(4)在实验过程中导管b不能直接与大气相通,理由为CO和CH3OH都是有毒物质且对环境有污染,
故答案为:不能;CO和CH3OH都是有毒物质且对环境有污染;
(5)大试管中溶液的作用有溶解甲醇、吸收甲酸,还有降低甲酸甲酯在水中的溶解度,利于分层析出的作用,
故答案为:降低甲酸甲酯在水中的溶解度,利于分层析出的作用;
(6)若大试管中溶液是NaOH溶液,则收集到的产物比预期的少,其原因是甲酸甲酯在NaOH溶液存在的条件下水解了一部分,
故答案为:甲酸甲酯在NaOH溶液存在的条件下水解了一部分.
点评 本题考查有机物的制备实验,为高频考点,把握制备反应原理、有机物的性质、混合物分离提纯方法等为解答的关键,侧重分析与实验能力的综合考查,注意该实验类比乙酸乙酯的制备,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{8}$mol 14CH4分子所含中子数为N0 | |
| B. | 7 g 14C原子形成的石墨完全燃烧生成二氧化碳时所转移的电子数为2N0 | |
| C. | 常温常压下,22.4 L含14C的二氧化碳中分子数等于N0 | |
| D. | 常温常压下,17 g甲基(-14CH3)所含电子数为9N0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
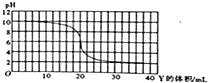
| A. | X和Y可能是KOH和CH3COOH | |
| B. | X和Y可能是NH3•H2O和HCl | |
| C. | X和Y恰好中和时,溶液呈中性 | |
| D. | X和Y恰好完全反应时的溶液中由水电离出的c(H+)=1×10-8mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10 | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | -2 | +2 | +1 | +5,-3 | +7,-1 | +1 | +5,-3 | +3 |
| A. | ⑧号元素为Al | |
| B. | 上述八种元素最高价氧化物对应的水化物⑤号酸性最强 | |
| C. | ②、③处于同一周期 | |
| D. | ④元素的气态氢化物沸点大干⑦元素的氢化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | K | L | M | Q | R | T | N |
| 原子半径/nm | 0.183 | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | 0.152 |
| 主要化合价 | +1 | +2 | +3 | +6、 -2 | +2 | -2 | +1 |
| A. | K、L、M三元素的金属性逐渐增强 | |
| B. | T元素的化合价除了-2价,只有0价 | |
| C. | Q元素的最高价氧化物为电解质,其水溶液能够导电 | |
| D. | K在T单质中燃烧所形成的化合物为淡黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
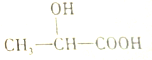
| A. | 1mol乳酸可以与足量的NaHCO3反应生成1molCO2 | |
| B. | 1mol乳酸可以与足量的钠反应生成1mol氢气 | |
| C. | 乳酸可以在一定条件下发生消去反应生成CH2=CHCOOH | |
| D. | 乳酸可以与NaOH溶液反应生成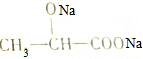 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com