
【题目】下列反应中,属于加成反应的是
A. 乙烯使酸性KMnO4溶液褪色
B. 将苯滴入溴水中,振荡后水层接近无色
C. 乙烯使溴水褪色
D. 甲烷与氯气混合,光照一段时间后黄绿色变浅
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D 4种元素的核电荷数依次增大,它们的离子的电子层数相同且最外层电子数均为8.A原子的L层电子数与K、M层电子数之和相等,D原子的K、L层电子数之和等于电子总数的一半.请回答下列问题:
(1)4种元素的符号依次是A , B , C , D . 它们的原子半径由大到小的顺序是 .
(2)试写出4种元素的离子结构示意图:A , B , C , D . 它们离子的半径由大到小的顺序 .
(3)它们最高价氧化物对应水化物的化学式分别是 , 分别比较它们酸性和碱性的强弱 .
(4)写出能够生成的气态氢化物的化学式: , 比较其稳定性: , 理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学方程式是能够很直接形象的表示化学反应的过程与特征的一种符号,书写化学方程式是我们必须掌握的一项基本技能。请按照要求完成下列方程式。
(1)写出 泡沫灭火器反应原理的离子方程式:______.
(2)工业制粗硅的化学反应方程式:_____________
(3)NaCN属于剧毒物质,有一种处理方法其原理为CN-与S2O32-反应生成两种离子,一种与Fe3+可生成红色溶液,另一种与H+作用产生能使品红溶液褪色的刺激性气体,写出CN-与S2O32-反应离子反应方程式:______。
(4)亚硝酸盐是食品添加剂中毒性较强的物质之一,可使正常的血红蛋白变成正铁血红蛋白而失去携带氧的功能,导致组织缺氧。将亚硝酸钠溶液滴加到K2Cr2O7酸性溶液中,溶液由橙色交为绿色,且亚硝酸根被氧化成硝酸根,试写出反应的离子方程式:___________
(5)将NaClO溶液逐滴滴入含淀粉的NaI溶液中,溶液变蓝,继续滴加,溶液颜色先加深,后逐渐变浅,最终消失。经检测得知此时溶液中含有一种含正五价元素的含氧酸根。写出上述变化过程中第二个反应的离子反应方程式:___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工厂使用石油热裂解的副产物甲烷来制取氢气,其生产流程如下图:

(1)此流程的第II步反应为:CO(g)+H2O(g) ![]() H2(g)+CO2(g),该反应的平衡常数随温度的变化如下表:
H2(g)+CO2(g),该反应的平衡常数随温度的变化如下表:
温度/℃ | 400 | 500 | 830 |
平衡常数K | 10 | 9 | 1 |
从上表可以推断:此反应是 (填“吸”或“放”)热反应。在830℃下,若开始时向恒容密闭容器中充入1mo1CO和2mo1H2O,则达到平衡后CO的转化率为 。
(2)在500℃,按照下表的物质的量(按照CO、H2O、H2、CO2的顺序)投入恒容密闭容器中进行上述第II步反应,达到平衡后下列关系正确的是 。
实验编号 | 反应物投入量 | 平衡时H2浓度 | 吸收或放出的热量 | 反应物转化率 |
A | 1、1、0、0 | c1 | Q1 | α1 |
B | 0、0、2、2 | c2 | Q2 | α2 |
C | 2、2、0、0 | c3 | Q3 | α3 |
A.2c1= c2 =c3 B.2Q1=Q2=Q3 C.α1 =α2 =α3 D.α1 +α2 =1
(3)在一个绝热等容容器中,不能判断此流程的第II步反应达到平衡的是 。
①v(CO2)正=v(H2O)逆
②混合气体的密度不变
③混合气体的平均相对分子质量不变 ④各组分的物质的量浓度不再改变
⑤体系的温度不再发生变化
(4)下图表示此流程的第II步反应,在t1时刻达到平衡、在t2时刻因改变某个条件使浓度发生变化的情况:图中t2时刻发生改变的条件是 、 (写出两种)。
若t4时刻通过改变容积的方法将压强增大为原先的两倍,在图中t4和t5区间内画出CO、CO2浓度变化曲线,并标明物质(假设各物质状态均保持不变)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验能成功的是( )
A.将铁屑、溴水、苯混合制溴苯 B.苯和硝基苯采用分液的方法分离
C.聚乙烯使酸性KMnO4溶液退色 D.用水鉴别:苯、乙醇、四氯化碳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义。
(1)用CO可以合成甲醇。已知:
①CH3OH(g)+3/2O2(g)![]() CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
②CO(g)+1/2O2(g)![]() CO2(g) ΔH=-283.0 kJ·mol-1
CO2(g) ΔH=-283.0 kJ·mol-1
③H2(g)+1/2O2(g)![]() H2O(l) ΔH=-285.8 kJ·mol-1
H2O(l) ΔH=-285.8 kJ·mol-1
则CO(g)+2H2 (g)![]() CH3OH(g) ΔH=________ kJ·mol-1。
CH3OH(g) ΔH=________ kJ·mol-1。
(2)下列措施中能够增大上述合成甲醇反应的反应速率的是________(填写序号)。
a. 使用高效催化剂 b. 降低反应温度
c. 增大体系压强 d. 不断将CH3OH从反应混合物中分离出来
(3)在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示。

①p1________p2(填“大于”、“小于”或“等于”);
②100 ℃时,该反应的化学平衡常数K=_______;
③100℃时,达到平衡后,保持压强P1不变的情况下,再向容器中通入CO、H2和CH3OH各0.5a mol,则平衡_______ (填“向右”、“向左”或“不”移动)。
④在其它条件不变的情况下,再增加a mol CO和2a molH2,达到新平衡时,CO的转化率________(填“增大”、“减小”或“不变”)。
(4)在容积均为1L的密闭容器(a、b、c、d、e)中,分别充入1molCO和2molH2等量混合气体,在不同的温度下(温度分别为T1、T2、T3、T4、T5),经相同的时间,在t时刻,测得容器甲醇的体积分数如图所示。在T1- T2及T4- T5两个温度区间,容器内甲醇的体积分数的变化趋势如图所示,其原因是_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下电解200mL一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图中Ⅰ、Ⅱ所示(气体体积已换算成标准状况下的体积),根据图中信息进行下列计算:(要求写出计算步骤) 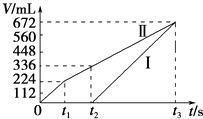
(1)原混合溶液中CuSO4的物质的量浓度.
(2)电解至t3时,消耗水的质量.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把1 mol甲烷和4mol氯气组成的混合气体充入到大试管中将此试管倒立在盛有饱和食盐水的水槽里,放在光亮处,一段时间后,推测可能观察到的现象
①黄绿色逐渐消失
②试管壁上有油珠
③试管内水面上升
④水槽内有少量晶体析出
A.只有①③ B.只有①②③ C.只有①③④ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铁片与稀硫酸反应制备氢气时,下列措施不能使氢气生成速率加快的是( )
A.铁片改为铁粉 B.稀硫酸改为98% 浓硫酸
C.对该反应体系加热 D.铁片改为锌片
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com