
| A. | 95℃纯水的pH<7,说明加热可导致水呈酸性 | |
| B. | pH=3的醋酸溶液,稀释至10倍后pH=4 | |
| C. | 0.2 mol•L-1的盐酸与等体积水混合后pH=1 | |
| D. | pH=3的醋酸溶液与pH=11的氢氧化钠溶液等体积混合后pH=7 |
分析 A.纯水中c(H+)=c(OH-),溶液呈中性;
B.醋酸为弱酸,加水稀释促进电离;
C.根据c(H+)=$\frac{n}{V}$,PH=-lg[c(H+)]计算;
D.pH=3的醋酸溶液,与pH=11的氢氧化钠溶液中:c(H+)=c(OH-)=1×10-3mol/L,但醋酸为弱酸,不完全电离,醋酸浓度大.
解答 解:A.水的电离为吸热过程,温度升高,促进电离,溶液中c(H+)增大,pH减小,但存在c(H+)=c(OH-),溶液呈中性,故A错误;
B.醋酸为弱酸,加水稀释促进电离,pH=3的醋酸溶液,稀释至10倍后pH<4,故B错误;
C.0.2mol/L的盐酸,与等体积水混合后,c(H+)=0.1mol/L,pH=1,故C正确;
D.pH=3的醋酸溶液,与pH=11的氢氧化钠溶液中:c(H+)=c(OH-)=1×10-3mol/L,但醋酸为弱酸,不完全电离,醋酸浓度大,与pH=11的氢氧化钠溶液等体积混合后,醋酸过量,溶液pH<7,故D错误;
故选C.
点评 本题考查酸碱混合的计算与判断以及弱电解质问题,题目难度中等,明确弱电解质电离的特点为解答关键,易错点为A,注意纯水中c(H+)=c(OH-).


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:选择题
| A. | 分液操作时,先将分液漏斗中下层液体从下口放出,再将上层液体从下口放出 | |
| B. | 萃取操作时,可以选用CCl4或酒精作为萃取剂从溴水中萃取溴单质 | |
| C. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| D. | 蒸馏操作时,应向蒸馏烧瓶中加入几块沸石,以防止暴沸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
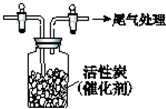 某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.查阅资料:SO2Cl2常温下为无色液体,极易水解,遇潮湿空气会产生白雾.
某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.查阅资料:SO2Cl2常温下为无色液体,极易水解,遇潮湿空气会产生白雾.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
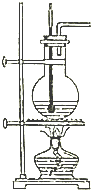 实验室用如图所示装置制取乙烯,请回答下列有关该实验的问题:
实验室用如图所示装置制取乙烯,请回答下列有关该实验的问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl→H2SO4→H2S→NaOH→CO2 | B. | NaCl→Na2SO4→NaOH→H2S→CO2 | ||
| C. | Na2S→Na2SO4→NaCl→NaOH→CO2 | D. | Na2SO4→HCl→H2S→NaOH→CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.05 mol | B. | 0.25 mol | C. | 0.1 mol | D. | 1 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
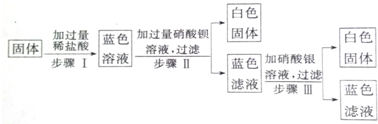
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com