
硫及其化合物有广泛应用。
(1)硫酸生产过程中涉及以下反应。已知25℃、101KPa时:
①2SO2(g)+O2(g)+2H2O(l)═2H2SO4(l)△H=-457kJ•mol-1
②SO3(g)+H2O(l)═H2SO4(l)△H=-130kJ•mol-1
则SO2催化氧化为SO3(g)的热化学方程式为______________________。
(2)对于SO3催化氧化反应:2SO2(g)+O2(g)?2SO3(g).
①甲图是SO2催化氧化反应时SO2(g)和SO3(g)的浓度随时间的变化情况.反应从开始到达到平衡时,用O2表示的平均反应速率为______________________。
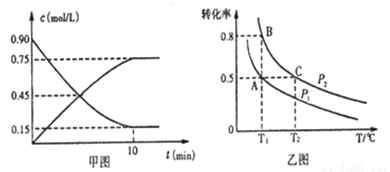
②在一容积可变的密闭容器中充入20molSO2(g)和l0molO2(g),O2的平衡转化率随温度(T)、压强(P)的变化如图乙所示.则P1与P2的大小关系是P1____________P2(填>、=或<);A、B、C 三点的平衡常数大小关系是______(用KA、KB、KC和>、=、<表示)。理由是____________。
(3)工业生成硫酸过程中,通常用氨水吸收尾气。
①如果在25℃时,相同物质的量的SO2与NH3溶于水,发生反应的离子方程式为____________。所得溶液中c(H+)-c(OH-)= ______(填序号)。
A.c(SO32-)-c(H2SO3) B.c(HSO3-)+c(SO32-)-c(NH4+)
C.c(SO32-)+c(NH3•H2O)-c(H2SO3) D.c(HSO3-)+2c(SO32-)-c(NH4+)
②已知:在25℃时NH3•H2O、H2SO3电离平衡常数如下表,则上述所得溶液中,各离子浓度由大到小的顺序为___________________________。
NH3•H2O | H2SO3 | ||
电离平衡常数为 (mol•L-1) | 1.7×10-5 | Ka1 | Ka2 |
1.54×10-2 | 1.02×10-7 | ||
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源:2015-2016学年河北邢台一中高二上学期期中测试化学试卷(解析版) 题型:选择题
下列说法中正确的是( )
A.处于最低能量的原子叫做基态原子
B.3p2表示3p能级有两个轨道
C.同一原子中,1s、2s、3s电子的能量逐渐减小
D.同一原子中,2p、3p、4p能级的轨道数依次增多
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山东寿光现代中学高一上12月月考化学卷(解析版) 题型:选择题
下列关于浓硫酸叙述正确的是
A.浓硫酸能使湿润的蓝色石蕊试纸先变红后变黑
B.浓硫酸在常温下可迅速与铜片反应,放出二氧化硫气体
C.浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体
D.浓硫酸在常温下能使铁铝等金属钝化,加热条件下也不反应
查看答案和解析>>
科目:高中化学 来源:2015-2016学年西藏日喀则中学高二上12月月考化学试卷(解析版) 题型:选择题
将纯水加热到较高温度,下列叙述正确的是( )
A.水的离子积变大、pH变小、呈酸性
B.水的离了积不变、pH不变、呈中性
C.水的离子积变小、pH变大、呈碱性
D.水的离子积变大、pH变小、呈中性
查看答案和解析>>
科目:高中化学 来源:2016届江西省高三上学期期中测试化学试卷(解析版) 题型:填空题
硼、镁及其化合物在工农业生产中应用广泛。已知:硼镁矿主要成分为Mg2B2O5•H2O,硼砂的化学式为Na2B4O7•10H2O.利用硼镁矿制取金属镁及粗硼的工艺流程如下.

回答下列有关问题:
(1)硼砂中B的化合价为_________,溶于热水后,常用H2SO4调pH到2~3制取H3BO3,反应的离子方程式为________。
(2)X为H3BO3晶体加热脱水的产物,其与Mg反应制取粗硼的化学方程式为________,MgCl2•7H2O脱水需要在HCl氛围中加热,其目的是________。
(3)硼氢化钠是一种常用的还原剂,它与水反应的离子方程式是BH4-+2H2O=BO2-+4H2↑。硼氢化钠在溶液中能把许多金属离子还原为金属单质,为了抑制它与水的反应,反应应在_______(填“酸性”“中性”或“碱性”)条件下进行,试完成并配平金离子(Au3+)被硼氢化钠还原的离子方程式:
_____Au3++____BH4-+_____OH-═___Au↓+______BO2-+____ ______。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年安徽省高一上期中测试化学试卷(解析版) 题型:选择题
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,其与水反应的化学方程式是:4K2FeO4+10H2O=4Fe(OH)3(胶体)+3O2↑+8KOH。工业上先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入一定量的KOH就可制得高铁酸钾。制备高铁酸钠的两种方法的主要反应原理如下:
湿法制备:2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O
干法制备:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑
下列有关说法中错误的是( )
A.高铁酸钾处理水时,高铁酸钾发生还原反应
B.湿法中每生成1mol Na2FeO4共转移3mol电子
C.干法中每生成1mol Na2FeO4共转移4mol电子
D.K2FeO4处理水时,不仅能杀菌,并使悬浮杂质沉降
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省高二上期中测试化学试卷(解析版) 题型:选择题
在水溶液中存在反应:Ag++Fe2+ Ag(s)+Fe3+(aq) ΔH<0,达到平衡后,为使平衡体系中析出更多的银,可采取的措施是( )
Ag(s)+Fe3+(aq) ΔH<0,达到平衡后,为使平衡体系中析出更多的银,可采取的措施是( )
A.升高温度 B.加水稀释
C.增大Fe2+的浓度 D.常温下加压
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西省高二上11月月考化学试卷(解析版) 题型:选择题
下列有关金属腐蚀与防护的说法正确的是( )
A.纯银器表面在空气中会因化学腐蚀渐渐变暗
B.地下输油钢管与外加直流电源的正极相连可保护其不受腐蚀
C.海轮外壳连接锌块是采用牺牲阴极的阳极保护法保护外壳不受腐蚀
D.当镀锡铁制品的镀层破损时,锡镀层仍能对铁制品起保护作用
查看答案和解析>>
科目:高中化学 来源:2015-2016学年贵州省高一上半期测试化学试卷(解析版) 题型:选择题
除去某溶液里溶解的少量杂质,下列做法中不正确的是(括号内的物质为杂质)
A.KNO3溶液(AgNO3):加过量KCl溶液,过滤
B.NaCl溶液(BaCl2):加过量Na2CO3溶液,过滤,再加适量盐酸
C.NaCl溶液(Br2):加CCl4,萃取分液
D.KNO3溶液(NaCl):加热蒸发得浓溶液后,降温,析出晶体后过滤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com