
| A. | 胶体稳定 | B. | 胶体有丁达尔效应 | ||
| C. | 胶体能净水 | D. | 胶粒直径在1-100nm之间 |
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称量时,将NaOH固体放在左盘内的纸上,称得质量为10.2 g | |
| B. | 用25 mL碱式滴定管量取高锰酸钾溶液,体积为16.60 mL | |
| C. | 用广泛pH试纸测稀盐酸的pH=3.2 | |
| D. | 用10 mL量筒量取NaCl溶液,体积为9.2 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向50 mL 1 mol•L-1的盐酸中加入烧碱,水的KW不变 | |
| B. | NH4Cl和NH3•H2O混合液中,二者对对方的平衡都起了抑制作用 | |
| C. | 有两种弱酸HX和HY且酸性HX>HY,则体积和浓度相同的NaX和NaY溶液中有c(Y-)>c(X-)>c(OH-)>c(H+) | |
| D. | 常温下0.1mol•L-1的HA溶液中c(OH-)/c(H+)=10-8,则0.01 mol•L-1HA溶液中c(H+)=1×10-4mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓、稀HNO3分别与Cu反应比较浓、稀HNO3的氧化性强弱 | |
| B. | 向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液 说明一种沉淀能转化为另一种溶解度更小的沉淀 | |
| C. | 测定等浓度的HCl、HNO3两溶液的pH 比较Cl、N的非金属性强弱 | |
| D. | 室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 研究浓度对反应速率的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ③④⑥ | C. | ③④⑤⑥ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用焰色反应鉴别NaCl、K2CO3 | |
| B. | 用氢氧化钠溶液鉴别MgCl2溶液和AlCl3溶液 | |
| C. | 利用丁达尔效应鉴别Fe(OH)3胶体与FeCl3溶液 | |
| D. | 用Ba(OH)2溶液鉴别Na2CO3和NaHCO3两种溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
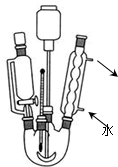
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com