
| A. | +1 | B. | +2 | C. | +3 | D. | +4 |
分析 反应中HNO3既做氧化剂又起到酸的作用,令金属单质元素氧化后化合价为b,则起酸作用的硝酸为0.5b mol,根据N原子守恒计算二氧化氮物质的量,再根据电子转移守恒计算.
解答 解:反应中HNO3既做氧化剂又起到酸的作用,令金属单质元素氧化后化合价为b,则起酸作用的硝酸为0.5b mol,反应中N元素化合价由+5价降低为+4,根据电子转移守恒有:0.5mol×(b-0)=(3-0.5b)mol×(5-4),解得b=3,
故选:C.
点评 本题考查氧化还原反应的有关计算,难度中等,注意若不明确金属单质时,可能存在两种情况:①HNO3全部用于作氧化剂,②HNO3既做氧化剂又起到酸的作用.


科目:高中化学 来源: 题型:解答题
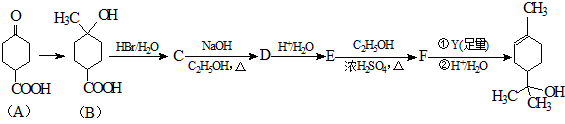
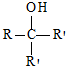
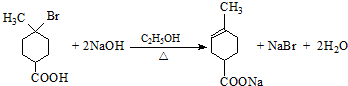 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl(H2S) | B. | O2(N2) | C. | CO(H2S) | D. | H2S(HCl) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用铜电极电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;点燃\;}}{\;}$H2↑+Cl2↑+2OH- | |
| B. | 向Na2SiO3溶液中加入盐酸:Na2SiO3+2H+═H2SiO3(胶体)+2Na+ | |
| C. | 向 溶液中通入少量CO2:2 溶液中通入少量CO2:2 +H2O+CO2→2 +H2O+CO2→2 +CO32- +CO32- | |
| D. | 向Mg(OH)2悬浊液中加入饱和NH4Cl溶液:2NH4++Mg(OH)2═2NH•H2O+Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度(K)CO2 转化率(%) n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2 | 60 | 43 | 28 | 15 |
| 3 | 83 | 62 | 37 | 22 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2 | B. | Cl2O | C. | ClO2 | D. | Cl2O7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com