


科目:高中化学 来源: 题型:
| 化学方程式 | K(t1) | K(t2) |
| F2+H2?2HF | 1.8×1036 | 1.9×1032 |
| Cl2+H2?2HCl | 9.7×1012 | 4.2×1011 |
| Br2+H2?2HBr | 5.6×107 | 9.3×106 |
| I2+H2?2HI | 43 | 34 |
查看答案和解析>>
科目:高中化学 来源: 题型:
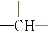 和一个-OH,则它们的可能结构有( )
和一个-OH,则它们的可能结构有( )| A、5种 | B、3种 | C、2种 | D、4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、SO42-、HCO3- |
| B、K+、SO42-、NO3- |
| C、Fe2+、Cl-、NO3- |
| D、Fe3+、ClO-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,1molCl2与足量NaOH溶液完全反应,转移的电子数2NA |
| B、常温常压下,32g氧气和臭氧混合气体中所含有的氧原子数为2NA |
| C、标准状况下,22.4L水所含原子数为3NA |
| D、同温同压下,NA个NO2与NA个N2和O2的混合气体的体积不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、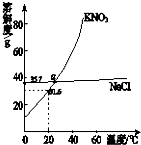 固体KNO3中混有NaCl,可用重结晶进行提纯 |
B、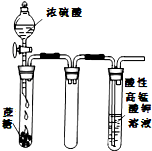 酸性KMnO4溶液中没有气泡出现,但溶液颜色会逐渐变浅乃至褪去 |
C、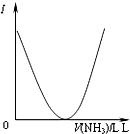 可表示乙酸溶液中通入氨气至过量过程中溶液导电性(I )的变化 |
D、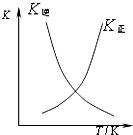 可表示在恒容密闭容器中反应“2SO2(g)+O2(g)═2SO3(g)△H<0”的平衡常数K正、K逆随温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、每生成1mol Na2ZnO2转移4mol电子 |
| B、负极反应式为:Zn+4OH--2e-=ZnO22-+2 H2O |
| C、电池工作时,溶液中的Na+向负级移动 |
| D、碱性或酸性电解液中,该电池正极反应式相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,11.2L氯仿中含有的C-Cl键的数目为1.5NA |
| B、标准状况下,30g NO和16g O2混合所生成的气体分子数为NA |
| C、某温度时,1L pH=6的纯水中含有1.0×10-6NA个H+ |
| D、28g铁粉与足量Cl2反应时转移的电子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com