
【题目】下列物质中的离子键最强的是( )
A.KCl
B.CaCl2
C.MgO
D.Na2O
科目:高中化学 来源: 题型:
【题目】到目前为止,由化学能转变的热能或电能仍然是人类使用最主要的能源.
(1)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关.已知:H2(g)+Cl2(g)=2HCl(g)△H=﹣a kJmol﹣1;E(H﹣H)=b kJmol﹣1 , E(Cl﹣Cl)=c kJmol﹣1 , 则:E(H﹣Cl)=;
(2)氯原子对O3的分解有催化作用:O3(g)+Cl(g)=ClO(g)+O2(g)△H1 , ClO(g)+O(g)=Cl(g)+O2(g)△H2 , 大气臭氧层的分解反应是O3+O=2O2△H.该反应的能量变化示意图如图1所示.则反应O3(g)+O(g)=2O2(g)的正反应的活化能为kJmol﹣1 . 
(3)实验中不能直接测出由石墨和氢气反应生成甲烷反应的反应热,但可测出CH4、石墨和H2燃烧反应的反应热,求由石墨生成甲烷的反应热.已知:
①CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=﹣a kJmol﹣1
②C(石墨)+O2(g)═CO2(g)△H=﹣b kJmol﹣1
③H2(g)+ ![]() O2(g)═H2O(l)△H=﹣c kJmol﹣1
O2(g)═H2O(l)△H=﹣c kJmol﹣1
则反应C(石墨)+2H2(g)→CH4(g)的反应热:
△H=kJmol﹣1 .
又已知:该反应为放热反应,△H﹣T△S可作为反应方向的判据,当△H﹣T△S<0时可自发进行;则该反应在什么条件下可自发进行 . (填“低温”、“高温”)
(4)有图2所示的装置,该装置中Cu极为极;当铜片的质量变化为12.8g时,a极上消耗的O2在标准状况下的体积为L. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的认识不正确的是( )
A.油脂在空气中完全燃烧转化为水和二氧化碳
B.蔗糖、麦芽糖的分子式都是C12H22O11,二者互为同分异构体
C.在水溶液里,乙酸分子中的-CH3可以电离出H+
D.在浓硫酸存在下,苯与浓硝酸共热生成硝基苯的反应属于取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列操作中,可以加快Fe与稀H2SO4反应速率的是
A. 往溶液中加入少量水
B. 往溶液中加入少量FeSO4固体
C. 往溶液中加入少量较浓H2SO4
D. 用98%的浓硫酸代替稀硫酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雯雯在自学碳酸钠性质时,查到了以下资料:
①CO2+Na2CO3+H2O=2NaHCO3 , CO2通入饱和碳酸钠溶液会产生白色沉淀,CO2不溶于饱和碳酸氢钠溶液。
②碳酸钠、碳酸氢钠在不同温度下的溶解度如表:
0 ℃ | 10 ℃ | 20 ℃ | 30 ℃ | |
Na2CO3 | 7.1 | 12.2 | 21.8 | 39.7 |
NaHCO3 | 6.9 | 8.1 | 9.6 | 11.1 |
【进行实验1】验证CO2通入饱和碳酸钠溶液会产生白色沉淀
①配制碳酸钠溶液:取100 g 20 ℃的水,加入35 g碳酸钠固体,搅拌后,静置,取上层清液。
②利用装置一进行实验,连续5分钟向新制得的碳酸钠溶液中通入CO2。
【发现问题】实验中,始终没有看到沉淀现象,原因是什么呢?雯雯进行了以下实验探究。
【进行实验2】
实验操作 | 实验现象 |
①取100 g 20 ℃的水,加入35 g碳酸钠固体,搅拌后,静置,取上层清液 | 没有出现白色沉淀 |
(1)在0 ℃~30 ℃,Na2CO3和NaHCO3的溶解度受温度变化影响较大的是。
(2)大理石与稀盐酸反应的离子方程式为。
(3)装置二中饱和碳酸氢钠溶液的作用是。
(4)【进行实验3】
实验操作 | 实验现象 |
①取100 g热开水,加入35 g碳酸钠固体,完全溶解,再降温至20 ℃,取上层清液 | 装置一和装置二中的碳酸钠溶液中均出现白色沉淀 |
雯雯在最初的实验中没有看到沉淀现象的原因是。
(5)CO2通入饱和碳酸钠溶液会产生白色沉淀的原因是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,装置(Ⅰ)是一种可充电电池,装置(Ⅱ)为电解池,装置(Ⅰ)的离子交换膜只允许Na+通过.电池充、放电的化学方程式为:
2Na2S2+NaBr3 ![]() Na2S4+3NaBr,当闭合K时,X极附近溶液变红色.
Na2S4+3NaBr,当闭合K时,X极附近溶液变红色.
下列说法正确的是( )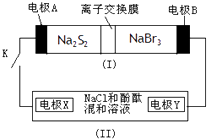
A.装置(I)中Na+从右到左通过离子交换膜
B.A电极的电极反应式为:NaBr3+2Na++2e﹣=3NaBr
C.X电极的电极反应式为:2Cl﹣﹣2e﹣=Cl2↑
D.每有0.1mol Na+通过离子交换膜,X电极上就生成标准状况下气体1.12L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知C、D、G、I为短周期元素形成的单质,D、G、I常温下为气态,且G为黄绿色;形成D的元素原子的最外层电子数是次外层的3倍;B的焰色反应呈紫色(透过蓝色钴玻璃);K为红棕色粉末.其转化关系如图:
请回答:
(1)写出E物质的电子式
(2)写出C与K反应的化学方程式 , 该反应的反应物总能量(填“大于”或“小于”)生成物总能量.
(3)L是目前应用最广泛的金属,用碳棒作阳极,L作阴极,接通电源(短时间)电解E水溶液的化学方程式 .
(4)H水溶液中离子浓度由大到小排序
(5)J与H反应的离子方程式为
(6)写出G与熟石灰反应制取漂白粉的化学方程式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com