
| A.Be | B.C | C.Ar | D.Ne |
 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
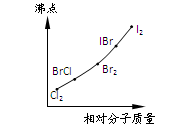
| A.Cl2至BrCl | B.BrCl至Br2 |
| C.Br2至IBr | D.IBr至I2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | | | | | a | | b | |
| 3 | c | d | e | f | | g | h | i |
| 4 | j | k | | | | | l | |
| 电离能kJ/mol | I1 | I2 | I3 | I4 |
| d | 738 | 1450 | 7730 | 10550 |
| e | 577 | 1817 | 2745 | 11578 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素 性质 | 8O | 16S | Se | 52Te |
| 单质沸点(℃) | -183 | 444.6 | 685 | 1390 |
| 主要化合价 | -2 | -2,+4,+6 | -2,+4,+6 | |
| 原子半径(nm) | 0.074 | 0.102 | 0.116 | 0.143 |
| 单质与H2反应 | 点燃易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com